循環器内科
循環器内科は、下記の研修施設です。
日本循環器学会
認定教育施設
専門医研修施設
日本心血管インターベンション治療学会研修施設
研修施設群基幹施設(CVIT研修施設)
日本不整脈心電学会研修施設
日本高血圧学会専門医認定施設
日本超音波学会専門医研修施設
当院での主な下記の治療について説明します。
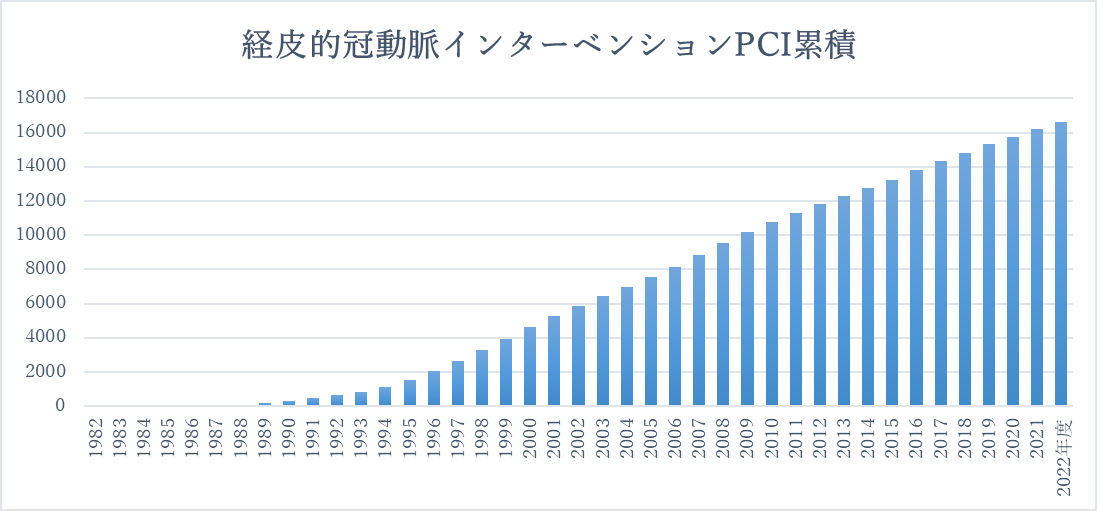
1.経皮的冠動脈インターベンション(PCI)
1)風船治療(POBA)
2)ステント治療
3)経皮的冠動脈形成術(特殊カテーテルによるもの)
ア ロータブレーター
イ エキシマレーザー
ウ ダイアモンドバック
エ 経皮的冠動脈粥腫切除術DCA
オ 冠動脈IVLシステム(血管内破砕術)ShockWave治療等 等
4.不整脈に対するカテーテルアブレーション
1)経皮的カテーテル心筋焼灼術(高周波アブレーション)
2)経皮的カテーテル心筋冷凍焼灼術(クライオバルーン)
3)経皮的カテーテル心筋焼灼術(ホットバルーン)
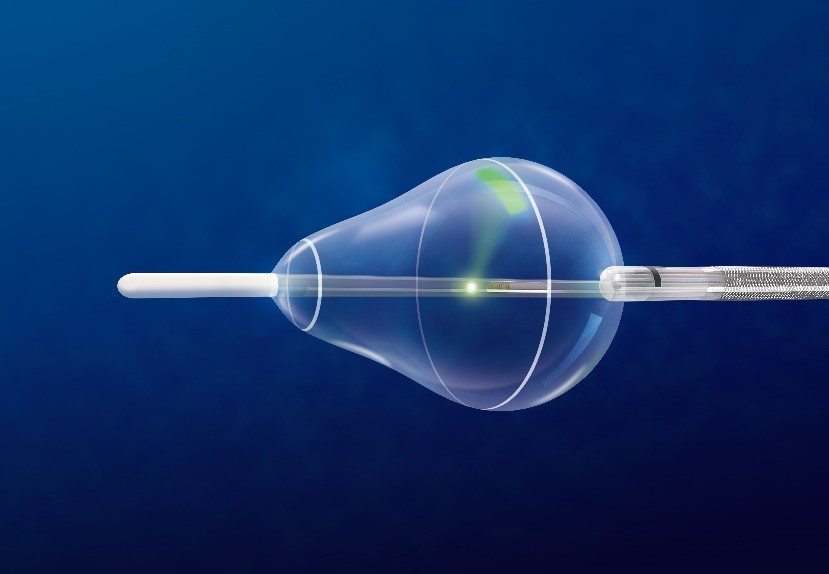
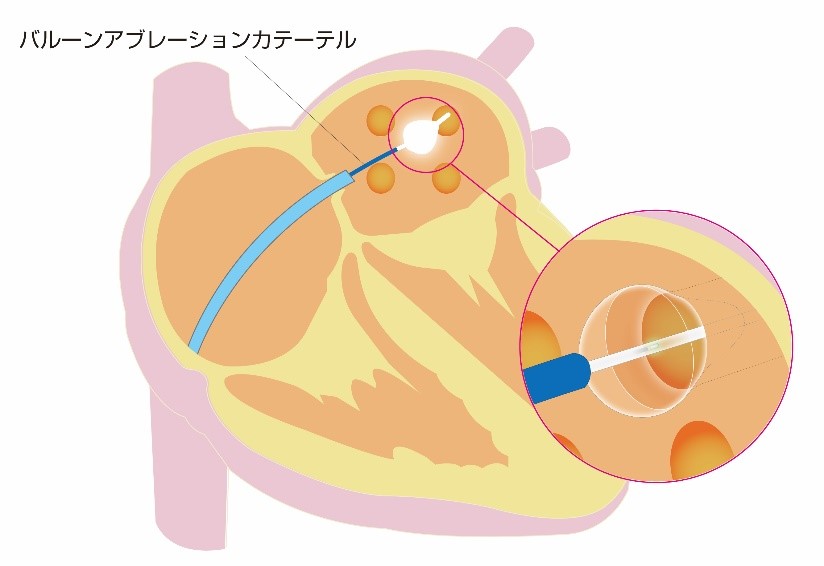
4)HeartLight 内視鏡アブレーション(レーザーバルーン)
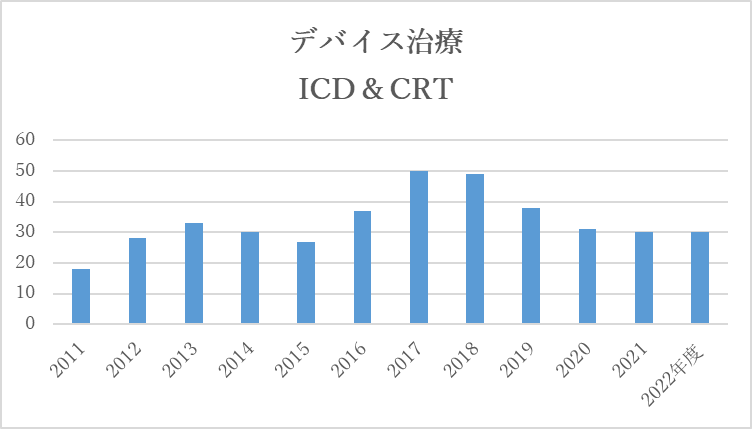
5.デバイス治療
1)ペースメーカ植込み
ア 経静脈リードを用いたペースメーカ植込み
右室心尖部ペーシング、心室中隔ペーシング
ヒス束/左脚エリアペーシング等
イ リードレスペースメーカ
2)植込み型除細動器(ICD)
ア 経静脈型(TV-ICD)
イ 皮下植込み型(S-ICD)
ウ 着用型自動除細動器(WCD)
3)心臓再同期療法(CRT)
6.経皮的ペースメーカリード抜去術
1)レーザーシースを用いないもの
ア メカニカルシース
イ Evolution RL Rotation ダイレータシース 等
2)エキシマレーザー心内リード抜去システム
7.経皮的カテーテル大動脈弁置換術・形成術(TAVI・BAV)
1.経皮的冠動脈インターベンション(PCI)
心臓は拡張と収縮を繰り返し、血液を全身に運ぶポンプの役割を果たしています。心臓自体に血液を供給するための血管が心臓を包むように分布しており、これを冠(状)動脈といいます。冠動脈は大きく分けると、左右の冠動脈からなり、左冠動脈は左前下行枝と左回旋枝の2本からなります。
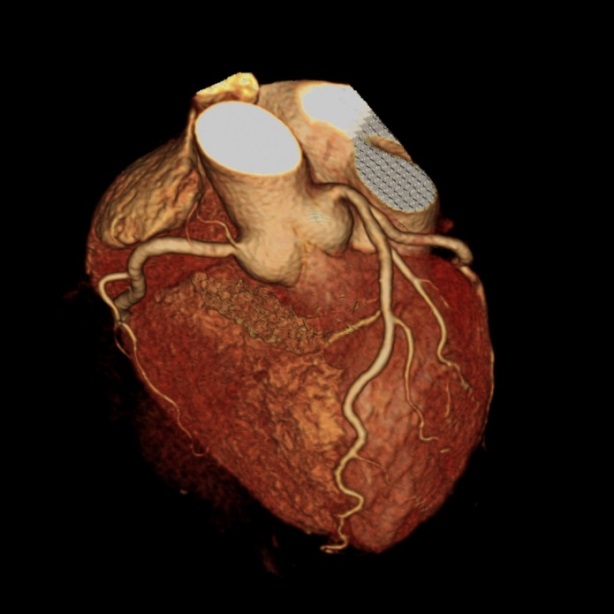
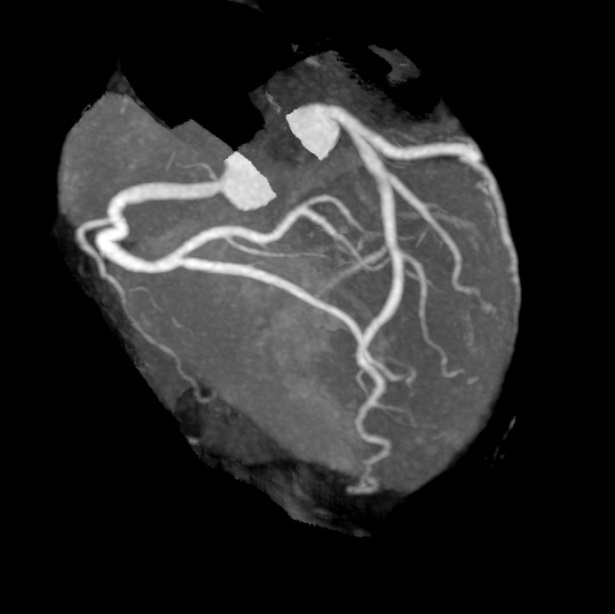
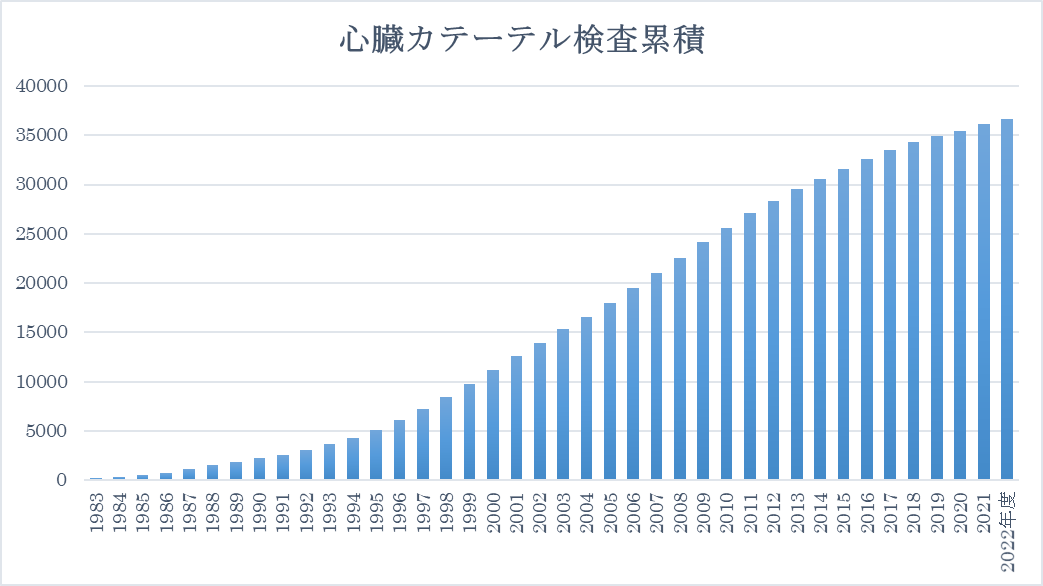
上記は、冠動脈CT検査ですが、選択的に冠動脈を造影する検査が選択的冠動脈造影です。当院は、これまで3万件以上施行しております。
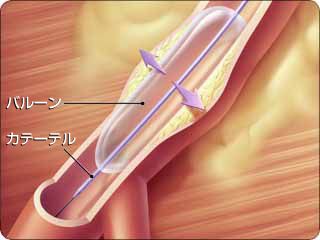
冠動脈の血管が、狭くなったり(狭窄)または閉塞した場合、血管の内側から広げる(拡張する)治療が、経皮的冠動脈インターベンション、冠動脈形成術(PCI)と呼ばれています。代表的な治療として、風船(バルーン)治療とステント治療があります。
1)風船治療(POBA)
ア.バルーン拡張:以前からあるデバイスで、冠動脈の血管の狭くなった部位をバルーン(風船)で拡張させる治療です。
イ.薬剤溶出バルーン:バルーンの表面に再狭窄を予防する効果のある薬が塗ってあります。これまでの風船治療と同じように病変部で拡張することで、薬が病変部に移行し、再狭窄を予防します。
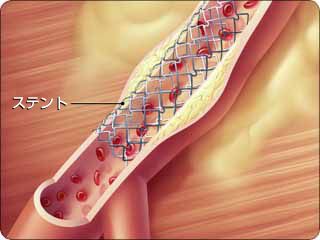
2)ステント治療
バルーン(風船)だけでは拡張が不十分な部位に、金属でできた支えとなるステントを留置する治療です。最近のステントには、再狭窄を抑える薬剤が塗布しており、薬剤溶出ステントと呼ばれています。
3)経皮的冠動脈形成術(特殊カテーテルによるもの)
ア.高速回転式経皮経管アテレクトミーカテーテル(ロータブレーター)
冠動脈の石灰化が強く、バルーンが病変部を通過しない、または通過してもバルーンが拡がらない場合があります。この場合は、高速回転式経皮経管アテレクトミーカテーテル(ロータブレーター)を使用してかたい部分を高速で削ります。このロータブレーターの治療は施設限定ですが、当院は使用可能ですのでご相談ください。
ロータブレーターは、図のように先端に細かいダイヤモンド粉末が塗りつけられた金属球を一分間に150,000回転以上で高速に回転させることにより、硬い部分を削る治療です。
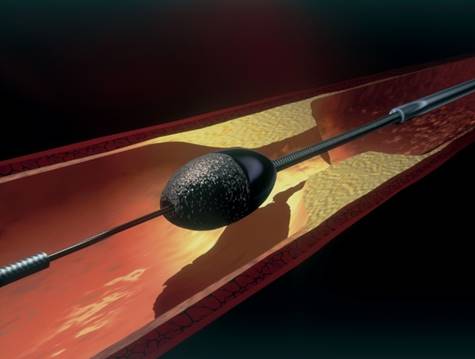
イ.エキシマレーザー血管形成用カテーテル(ELCA)
カテーテルの先端からレーザー光(エキシマレーザー)を冠動脈内の病変組織に照射して、冠動脈内の狭窄あるいは閉塞部を蒸散(組織除去)させる治療です。

ウ.ダイアモンドバック(OAS)
バーサイズは1.25mmで、ロータブレーターと同様に高速回転(8万、12万)させることにより、かたい部分を削る治療です。バー自体が小さく、ダイヤモンドコーティングが側面にもあるため、進めるときだけでなく引きながらでも削ることが出来ます。
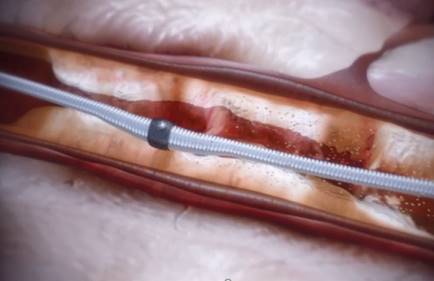
エ.経皮的冠動脈粥腫切除術(DCA)
デバイスは、筒状の器具であり、片側に回転する刃があり、その反対側にバルーンが内蔵されています。このデバイスを病変部に進め、バルーンをふくらませて刃のついている部分を動脈硬化の粥腫に押し付けて、刃を回転させてカンナのように削り取る治療です。
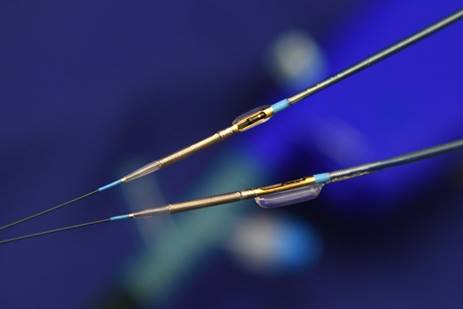
オ.冠動脈IVLシステム(血管内破砕術)ShockWave治療
重度の石灰化に対して、これまでロータブレータとダイアモンドバックが使用されてきましたが、新たなデバイスとしてshockwave治療ができるようになりました。石灰化のある血管内部でバルーンカテーテルから衝撃波を用いて堅い部分を破砕する治療法です。

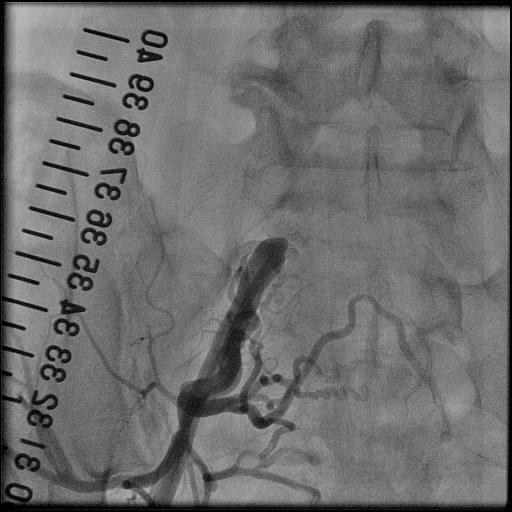
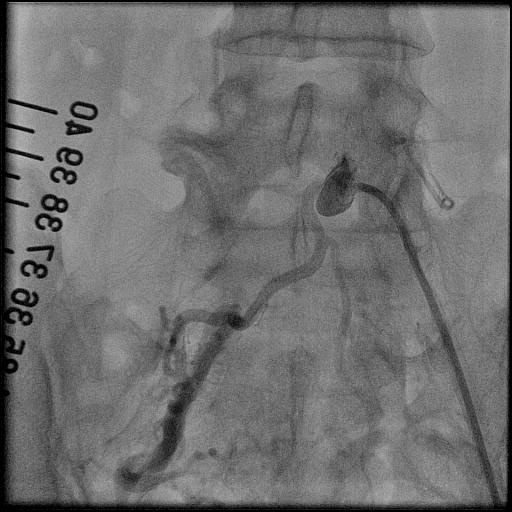
2.末梢動脈インターベンション(PTA)
脳動脈疾患CVD、冠動脈疾患CAD,末梢動脈疾患PADは、動脈硬化が基盤となって血栓ができ、血管が詰まるという共通の発症経過を示すことから、最近統一した疾患概念として「アテローム血栓症(ATIS)」と呼ばれています。特にPADを有する患者さまにおける心筋虚血有病率は55%にも及び、重症のPAD患者さまの生命予後は不良であるといわれています。PADに糖尿病が合併すると心血管死がさらに増加することも分かってきました。これまでシロスタゾールやスタチンなどの内服に加え、腸骨動脈領域を中心にインターペンション(PTA)をしてきましたが、大腿動脈以下のPTA治療も増えてきております。
冠動脈と同じように、骨盤部や下肢の末梢血管の動脈硬化による狭窄・閉塞部を細いカテーテルに装着したバルーン(風船)やステント(金属の筒状のもの)を使用して、病変部を拡張させることにより血流を改善させる治療です。
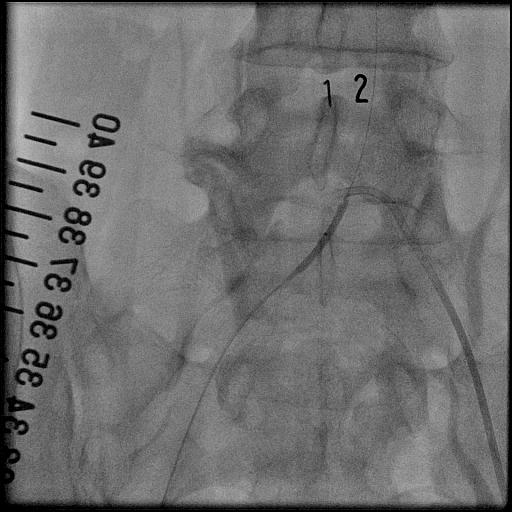
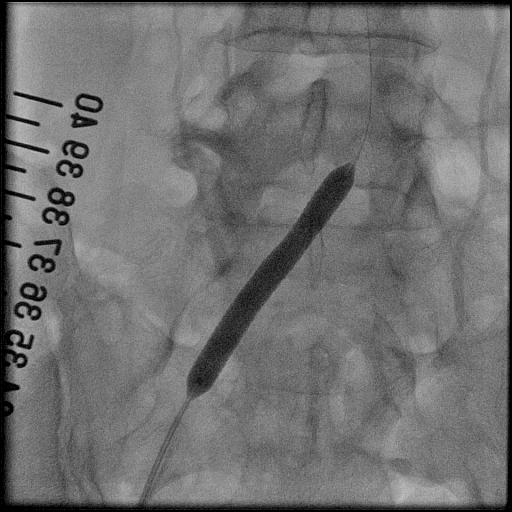
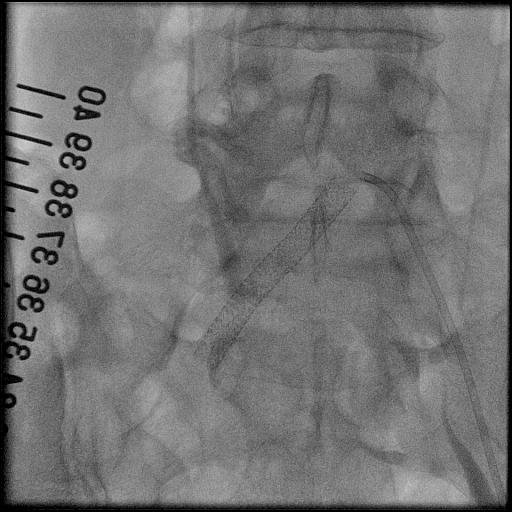
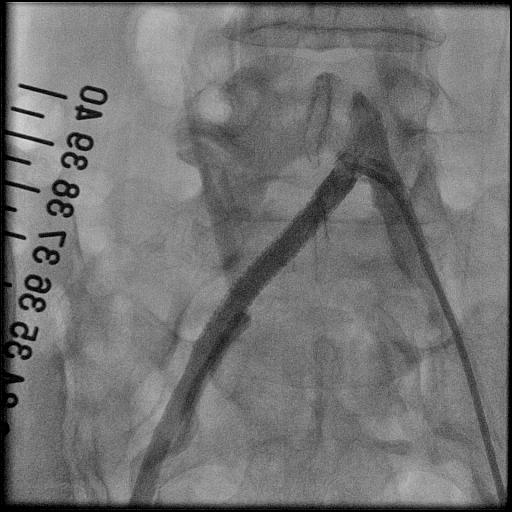
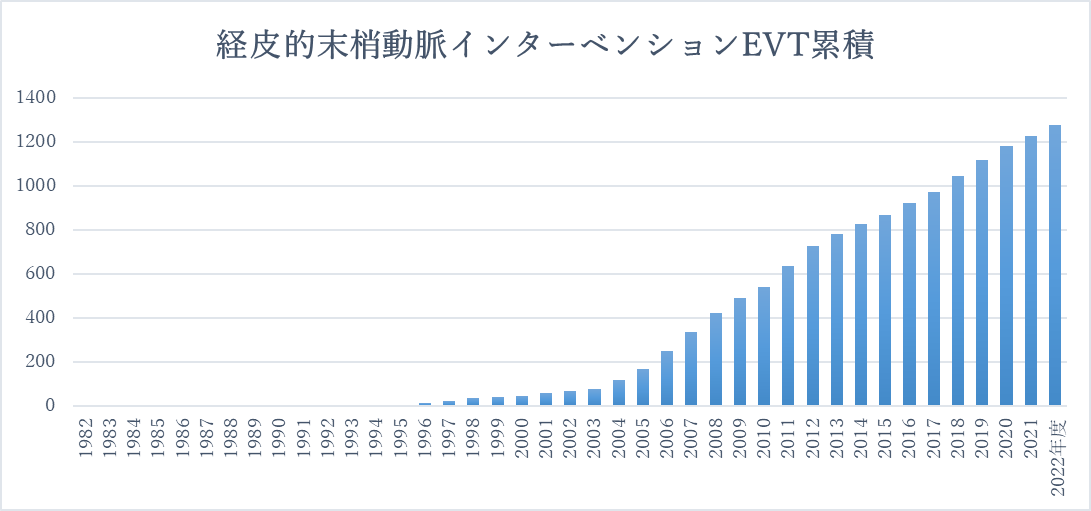
3.大動脈瘤に対するステントグラフト内挿術治療
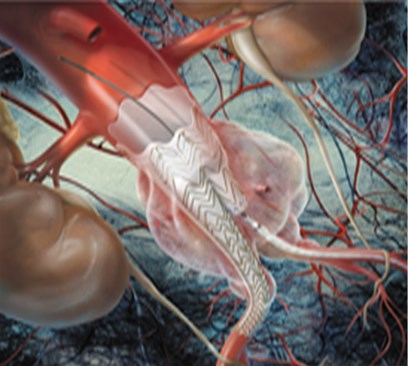
大動脈は、心臓から全身に血液を送る重要な血管です。加齢や動脈硬化等により血管の壁が弱くなると、大動脈が膨らみ、こぶのようになることがあります。胸部にできたものを胸部大動脈瘤、腹部にできたものを腹部大動脈瘤といいます。瘤が大きくなると、やがて破裂し、大出血から死に至る危険性があります。何らかの侵襲的治療が必要であり、外科的な人工血管置換術が主ですが、ステントグラフト内挿術に適した方もおられます。
ステントグラフトとは、人工血管(グラフト)に針金状の金属(ステント)を縫い合わせたものであり、それを血管内からカテーテルを操作して動脈瘤の部位で広げて血管を補強する治療法です。
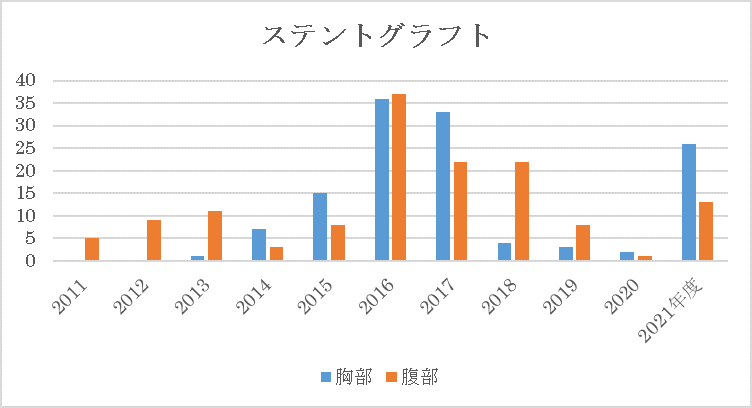
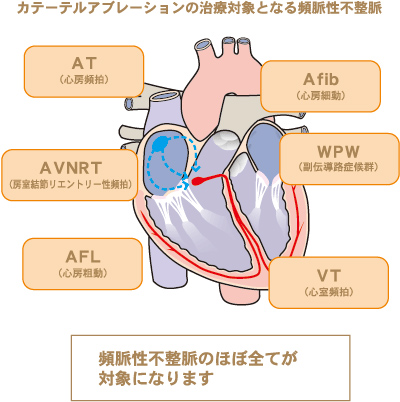
4.不整脈に対するカテーテルアブレーション
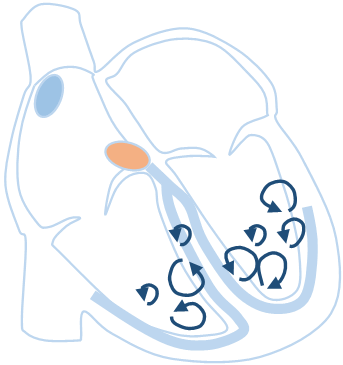
カテーテルアブレーションとは 脈が速くなる頻脈性不整脈の原因には、大きく2つあります。一つは、心臓の中に電気回路を持ってしまい、あるきっかけで電気回路を電気信号が回りだす(リエントリー)ために頻脈になるものと、もう一つはある一点から異常な信号が持続的に出現する(異常自動能)ために頻脈になります。
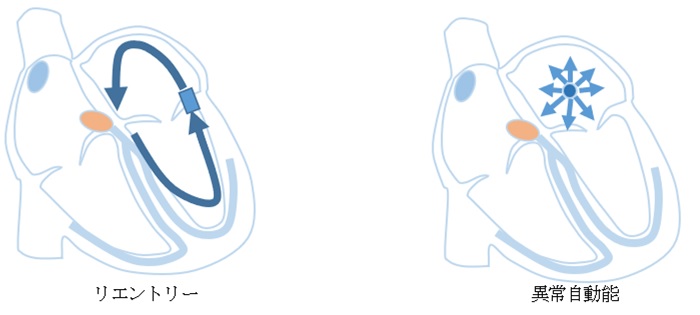
下記の図の心房頻拍(AT)の一部、房室結節回帰性頻拍(AVNRT)、副伝導路症候群(WPW)、心房粗動(AFL)、心室頻拍(VT)がリエントリーによる頻拍です。心房頻拍の一部が異常自動能にあたります。
カテーテルアブレーションの方法 カテーテルアブレーション(正式名:経皮的カテーテル心筋焼灼術)は、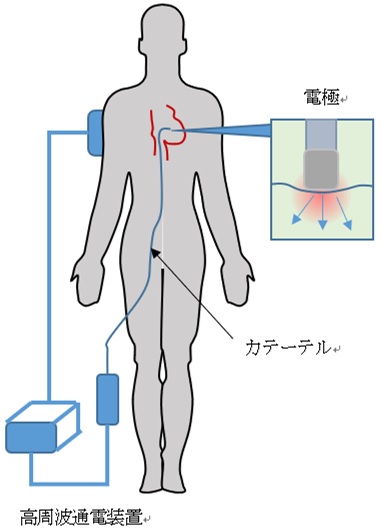 カテーテルの先端から高周波を流すことで熱をもたせ、電気回路を遮断、もしくは異常自動能の起源を焼き切ってしまい、正常の心拍に戻す治療法です。外科的に開胸するのではなく、カテーテルと言われる、電極を数本心臓の中に挿入し治療します。 カテーテルアブレーションは1980年に開発され、頻脈性治療に貢献してきました。その後、三次元マッピングの技術が開発発展し、より複雑な頻拍に対して治療が可能になりました。当院でも2010年4月から3次元マッピングシステムの一つであるCARTOシステムを導入し、カテーテルアブレーション治療向上を図っています。
カテーテルの先端から高周波を流すことで熱をもたせ、電気回路を遮断、もしくは異常自動能の起源を焼き切ってしまい、正常の心拍に戻す治療法です。外科的に開胸するのではなく、カテーテルと言われる、電極を数本心臓の中に挿入し治療します。 カテーテルアブレーションは1980年に開発され、頻脈性治療に貢献してきました。その後、三次元マッピングの技術が開発発展し、より複雑な頻拍に対して治療が可能になりました。当院でも2010年4月から3次元マッピングシステムの一つであるCARTOシステムを導入し、カテーテルアブレーション治療向上を図っています。
心房細動のカテーテルアブレーション 治療を要する不整脈で最も多い不整脈が心房細動ですが、一定の回路や持続する起源をもっているわけではないため、カテーテルアブレーションは難しいと考えられていました。
しかし、1998年にフランスのHaissaguerre先生が、心房細動の発生は不規則で早い連続的な異常電気信号(上室性期外収縮)が契機となることを発見しました。これまでのカテーテルアブレーションは、ほとんどの頻拍の契機になる期外収縮ではなく、そのあとに頻拍を持続させる電気回路や異常自動能を治療の対象としており、契機となる期外収縮は治療の対象としていませんでした。しかし、心房細動の契機となる上室期外収縮をなくすことで、心房細動の発症を抑えられるのではないかと考え、この治療が始まりました。上室性期外収縮の多くは、肺静脈周囲及び肺静脈開口部から迷入している心筋から発生することがわかり、肺静脈を電気的に隔離し、上室性期外収縮を抑えこむことで、多くの症例が洞調律を維持することが可能となったため、世界中に心房細動に対するアブレーションが普及しました。
現在は、左右肺静脈をそれぞれ上下同時に広範囲に囲むように線状焼灼する方法が一般的ですが、従来の高周波ABLでは、1回の焼灼で焼灼できる範囲は3-5mm前後であり、1周約10-20cmの肺静脈隔離は時間を要し、その習熟には多くの経験も必要としていました。
そのため、近年、技術革新により発作性心房細動に対してバルーンテクニックが開発されました。肺静脈入口部にバルーンを押し付け、冷凍もしくは加熱する方法で一気に肺静脈を電気的に隔離する方法です。
わが国では2014年7月より肺静脈電気的隔離術の際に第2世代のクライオバルーン(冷凍バルーン)を使用できるようになり、加熱するホットバルーンが2016年4月から保険償還され、国内で使用できるようになりました。
従来の高周波によるカテーテルアブレーションと比較し、冷凍もしくはホットバルーンにより、1回の焼灼で1本の肺静脈の電気的隔離が可能となり、手技時間も短く、簡便となりました。
バルーンカテーテルが適応となる患者さまは、発作性心房細動(1週間以内に心房細動が停止し正常調律に戻る)です。治療対象になる肺静脈が拡大していたり、通常の形態をしていない場合はバルーンで肺静脈を閉塞できないため治療できません。バルーンカテーテルで治療ができるかどうかは、主治医とご相談ください。 当院でも、2016年8月1日より、ホットバルーン、2017年10月13日より、クライオバルーンによる肺静脈隔離術を開始しています。
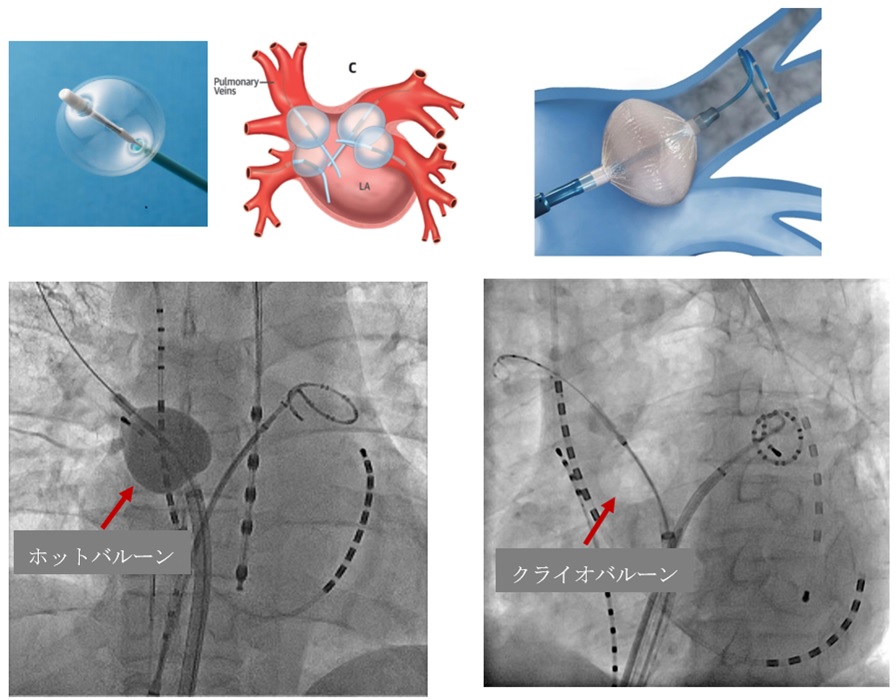

カテーテルアブレーションで肺静脈を隔離する手段は、カテーテルという電極の先端に高周波を流し、熱を発生させる方法です。1回の焼灼は約20-30秒で、約3-4mmの範囲です。肺静脈の周囲を焼灼するには、20~50回の焼灼が必要で、技術的にも難しい手技になります。そのため、もっと短時間で、簡単に治療が進まないかと開発されたのが、バルーンによる肺静脈隔離です。
肺静脈の入り口でバルーンを膨らませ、入口部で1本の血管を塞ぎ、一気に電気的に隔離をしてしまう方法です。現在、3種類のバルーンが認可されています。これまで、当院でもホットバルーン、クライオバルーンを使用してきましたが、この度レーザーバルーンを導入いたしました。
① ホットバルーンは、バルーン内の液体を熱することで隔離する方法
② クライオバルーンは冷凍のガスを入れて冷却することで隔離する方法
③ 今回導入するレーザーバルーンは、レーザーを当てて、熱を発生させ電気的に隔離する方法
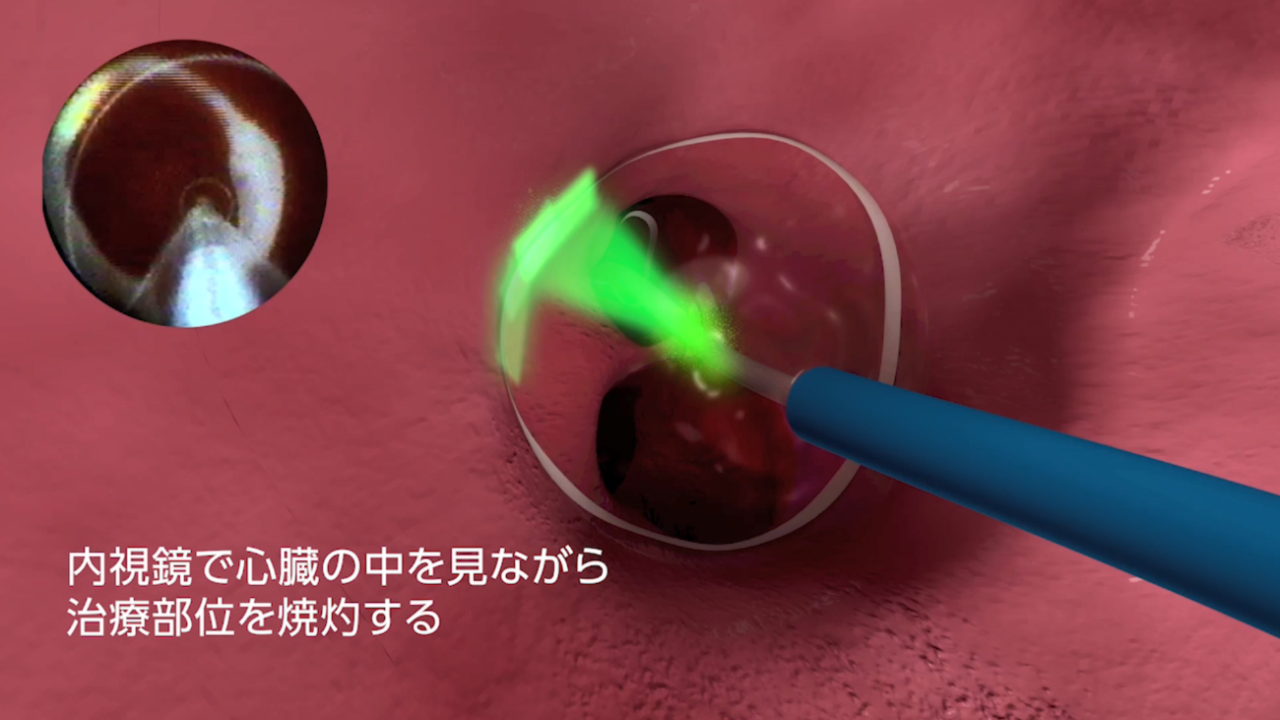
それぞれ特徴はありますが、レーザーバルーンはバルーン内に挿入した内視鏡で直接焼灼部位を見ながら治療をすることができます。また、基本的には造影剤の使用の必要はなく、焼灼部位の内膜損傷が少なく、焼灼した部位の再伝導が少ないという特徴があります。
患者さんの病歴、治療する肺静脈の形態、併せ持つ不整脈を考慮し、最適な治療法ができる選択肢がもう一つ増えることとなりました。
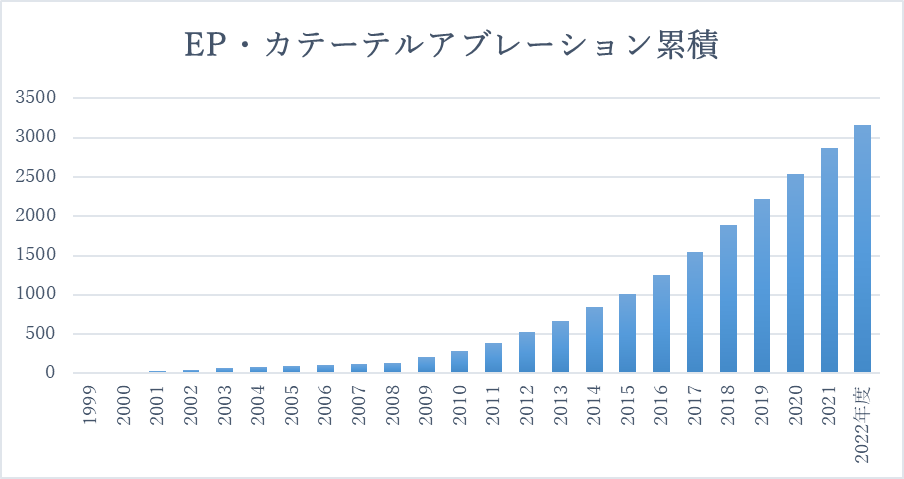
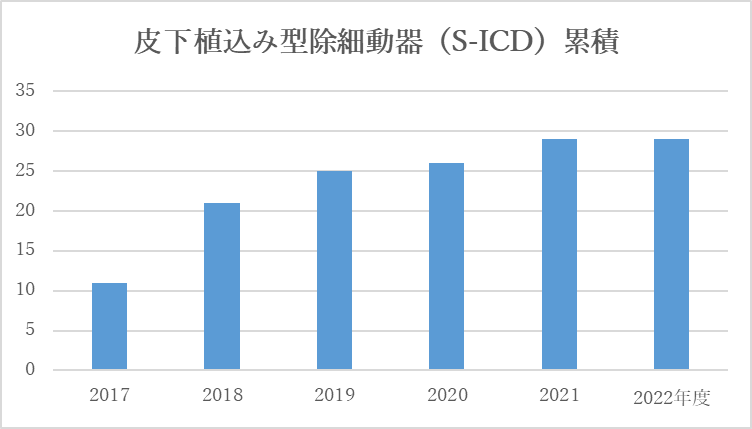
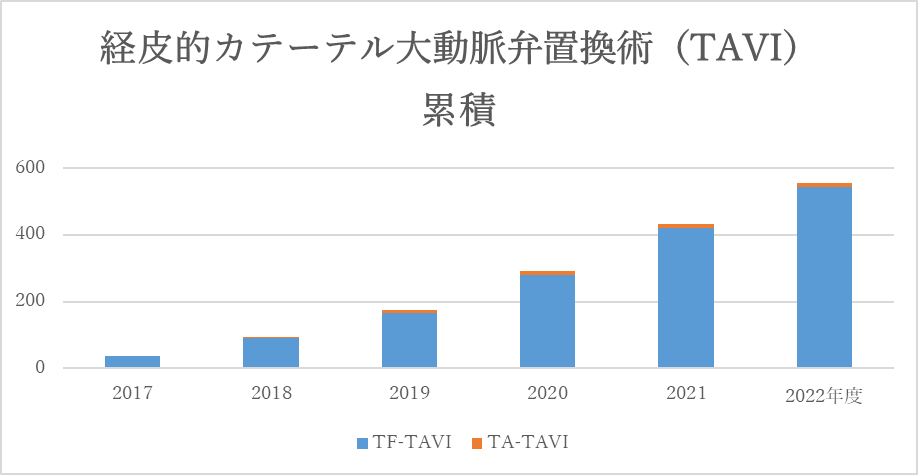
カテーテルアブレーション累積件数
5.デバイス治療
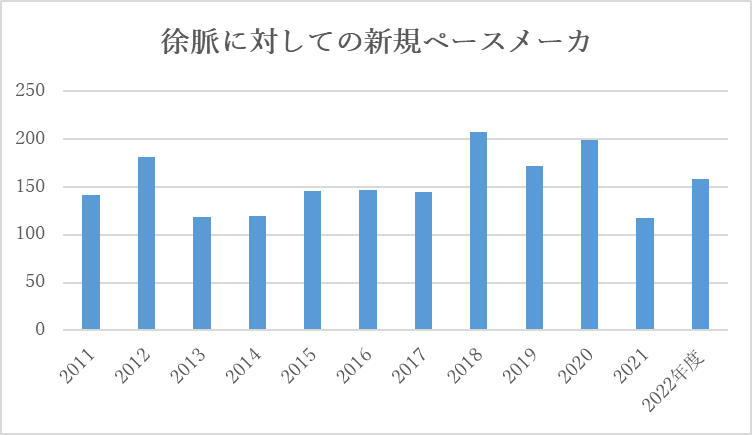
1)ペースメーカ植込み
- ペースメーカは、徐脈に対する確立された治療法です。
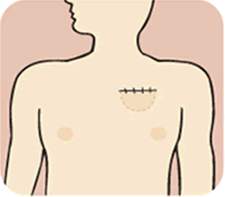
通常は、胸部の皮下ポケット鎖骨の下側に植込まれる電子部品および電池を内蔵したペースメーカ本体と、同部位から経静脈的に心臓までの導線(リード)からなります。リードは右心房または右心室の任意の部位に植込みペーシング治療を行います。
そのため、橈骨皮静脈を剥離してリードを挿入するか、鎖骨下静脈穿刺にてリードを挿入していました。最近は胸郭外鎖骨下穿刺法を全症例で施行しております。
●ヒス束ペーシング
右室ペーシングは医原性左脚ブロックによる左室非同期性収縮を誘発し、収縮機能不全を招く可能性があります。その代替ペーシング部位としてヒス束エリア及び左脚エリアを選択することで心室内正常伝導が維持され、右室ペーシングによる副作用が軽減することを目指します。また、両心室ペーシングが不成功の場合、オプションとしてヒス束ペーシングも期待されています。
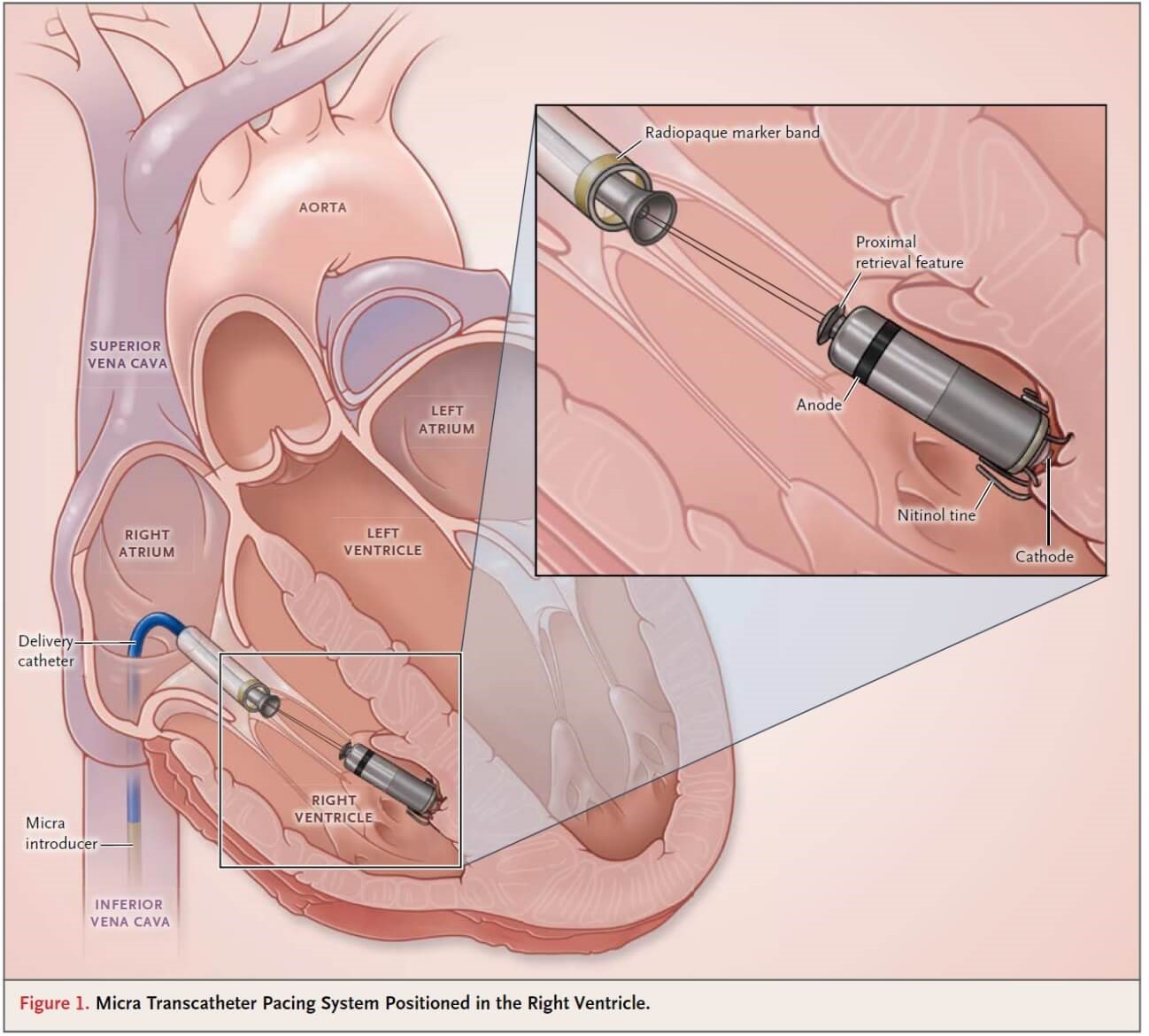
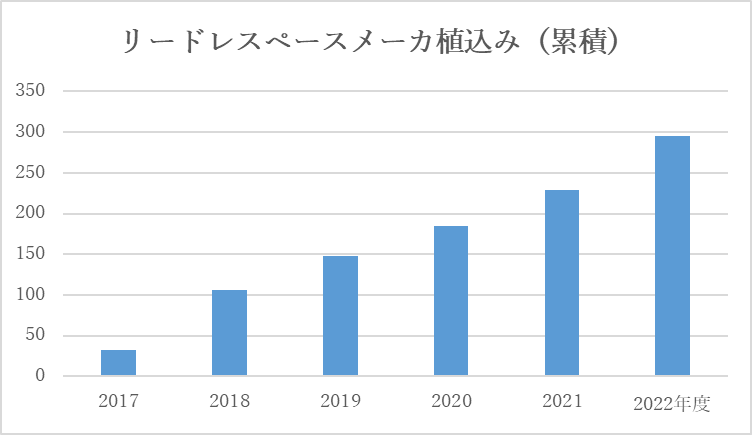
●リードレスペースメーカ
2017年9月に本邦において、リードレスペースメーカ植込み(Micra)が保険償還され、当院においても2017年9月14日に第1例目を開始し、2021年7月で200件を達成しました。

リードレスペースメーカは、大腿静脈からアプローチし、わずか容積0.8cc/重さ1.75gのデバイスを右室内に挿入するペースメーカです。これまで心室ペーシング(VVI / VVIR)設定のみに限定されるペーシングモードでしたが、Micra AVが2021年11月より使用できるようになり、安静時の房室同期が可能となりました。植込み手技における手順に違いはありません。
Micra AVは加速度センサーによる心房機械的センシングで得られた情報をもとに房室同期ペーシングを実現します。デバイスにはペーシングする電極とコンピュータ、電池がすべて組み込まれており、予測電池寿命は約8~13年で、1.5/3テスラ全身MRI対応しています。
これまで通り、Micraの留置には専用の23Frの太い血管造影用シースを挿入する必要があり、大腿静脈に関連した血腫や血管損傷、心タンポナーデなどの合併症があり、三尖弁損傷やペースメーカ脱落など、従来の経静脈ペースメーカにはなかった様々な問題もあります。リードがないこととジェネレータを皮下に植込む必要がないことから、近年増加傾向にあるデバイス感染が少ないとされていますが、必ずしも合併症はゼロにはならず、異物を身体の中に留置しますので注意が必要です。
これまで、リードレスペースメーカ植込み適応は、VVI型ペーシングに適した患者のうち、下記の疾患を持つものとされていました。
① 心房細動を併発した症候性の発作性または慢性の高度房室ブロック
② 心房細動を併発しない症候性の発作性または慢性の高度房室ブロックを有し、心房へのリード留置が困難またはハイリスクあるいは効果的と認められない場合
③ 症候性の徐脈頻脈症候群または洞機能不全症候群で、心房へのリード留置が困難またはハイリスクあるいは効果的と認められない場合
ペースメーカ植込みが必要な患者さん全てに適応があるわけではありませんが、房室同期ペーシング機能が新たに加わり、適応範囲が広がったと思います。
経静脈ペースメーカでのリード抜去後や残存リードの存在、リード留置可能なアクセスルートがない、胸部の皮下組織がない、ペースメーカ感染等のリスクの可能性が高いなどでお困りの患者さんがおられましたらご相談ください。
2)植込み型除細動器(ICD)
何の兆候もなく、元気だった人が突然亡くなってしまうことを、「突然死」、といいます。医学的には、発症から死亡までが24時間以内のものと定義されています。突然死の原因の約6割は心臓が原因ですが、その直接的な原因のほとんどは不整脈です。
生命に危険を及ぼす不整脈を止めるには、電気的除細動で止めるしかありませんが、可能な限り早急な治療が必要です。発症から1分ごとに7~10%救命率は下がり、10分以上経過するとほとんど命は助かりません。近年、運動場、劇場や役所などの公共施設に、AED(自動体外式除細動器)が設置されているのはご存知の方も多いかと思いますが、植込み型除細動器(ICD)はAEDと同様の機能を持った機械で、ひとたび命に関わる危険な不整脈が出現したときは自動的に電気ショックをかけて、不整脈を止めるものです。
植込み型除細動器が必要な主な病気
心室細動
心室が不規則に興奮し、全く血液を拍出できない。そのため早急に除細動しなければ命に関わる。
正常心拍
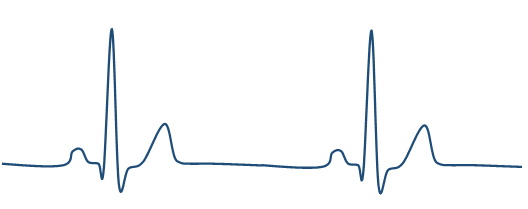
心室細動
心室頻拍
心室内で電気信号が規則的に電気回路を回っているか、ある一点から電気信号が出ている状態。血圧が保たれている場合もあるが、極端に脈拍が速い場合は、心室細動と同様、血液を拍出できないため生命に危険を及ぼす場合がある。
心室頻拍
突然死の原因となる不整脈に対しての植込み型除細動器(ICD)は、これまで経静脈的に植込みしておりました。
植込み型除細動器(ICD)の段階的治療
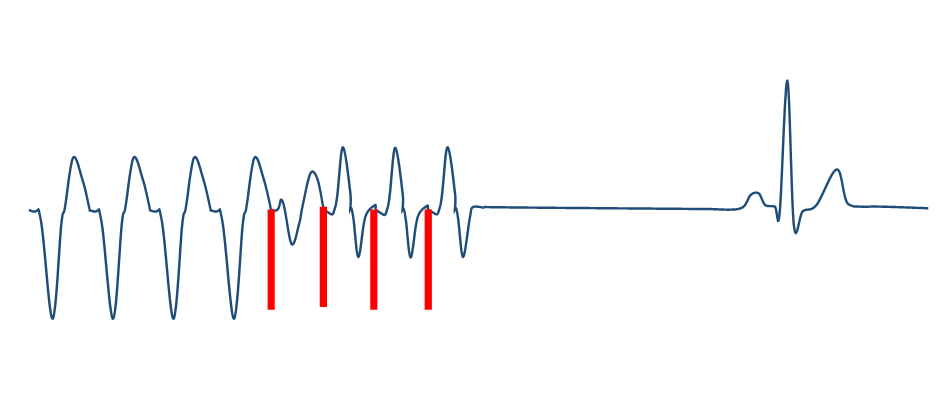
<ペーシング治療>
ペースメーカの機能を利用して心室頻拍を治療します。
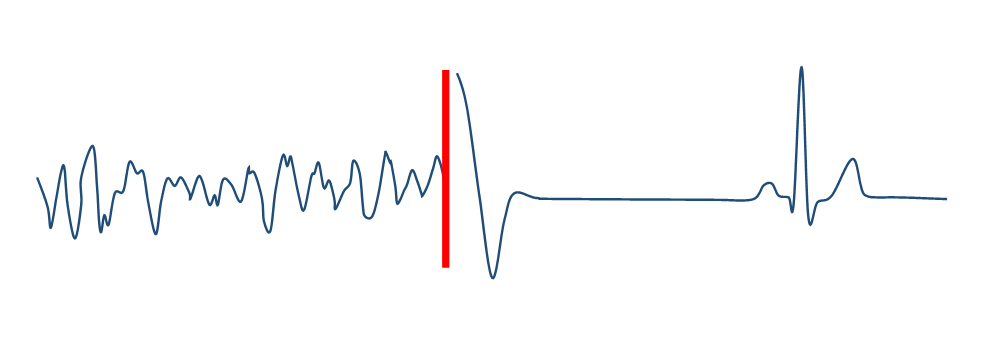
<除細動治療>
最大のエネルギーによる電気ショック治療。電気ショックが出ると、急に叩かれたような痛みがありますが、失神などにより治療自体に気が付かない場合があります。
皮下植込み型除細動器(Subcutaneous Implantable Cardioverter Defibrillator:S-ICD)は、血管内にリードを入れず、前胸部の皮下に除細動リードを植込むシステムです。そのため、経静脈的ICDで問題となっていたデバイス感染症、またリード抜去時のリスクが減少するとともに、リード断線も起こりにくくなることが期待されています。また、デバイス本体は、いまだサイズが大きいですが、腋窩(脇の下)に植込まれますので目立ちにくくなり、患者さまの印象は良いとのことです。
当院でも、2017年5月17日より、当院で皮下植込み型除細動器S-ICD植込みを開始しました。
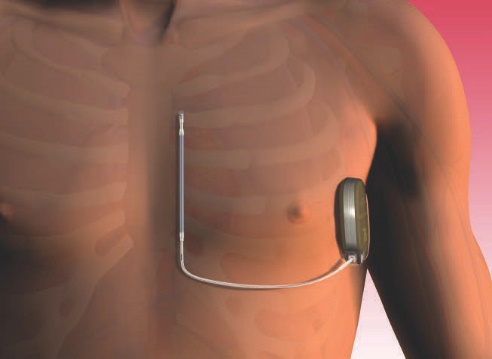
図)2017 Boston Scientific Corporation. All rights reserved.
3)心臓再同期療法(CRT)
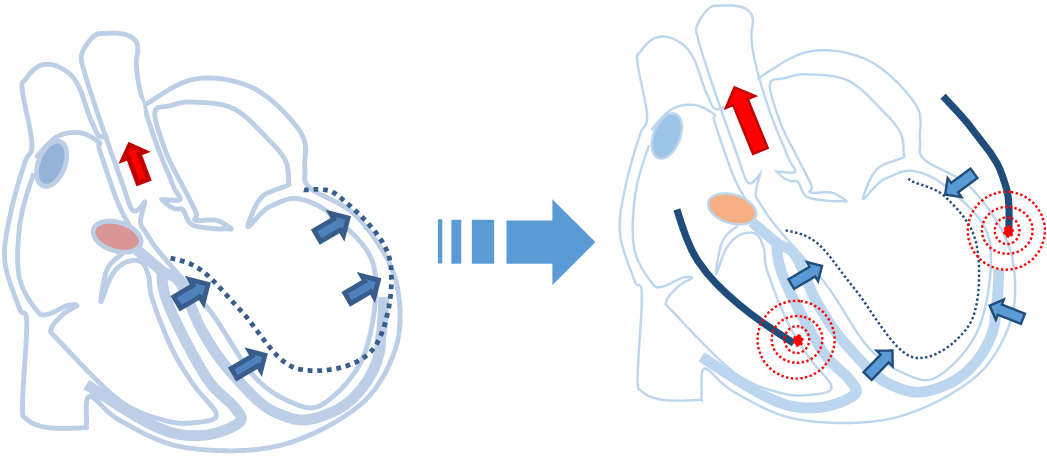
心臓の収縮が何らかの原因で障害され、程度が強くなると、心臓から全身に拍出される血液の量が少なくなります。そうすると、息切れ、倦怠感、呼吸苦などの心不全症状が出現します。心臓が拡大し、心臓の収縮にズレが生じることがあります。心機能が低下しているうえにさらに収縮にズレが生じることでポンプとしての効率が悪くなり、心不全が悪化します。その収縮のズレを補正するために、心室を両方から刺激することで、心機能が悪いながらも効率よく収縮させるためのペースメーカです。
正常な心臓の収縮
心室が均等に収縮し、効率よく血液を全身に拍出します。
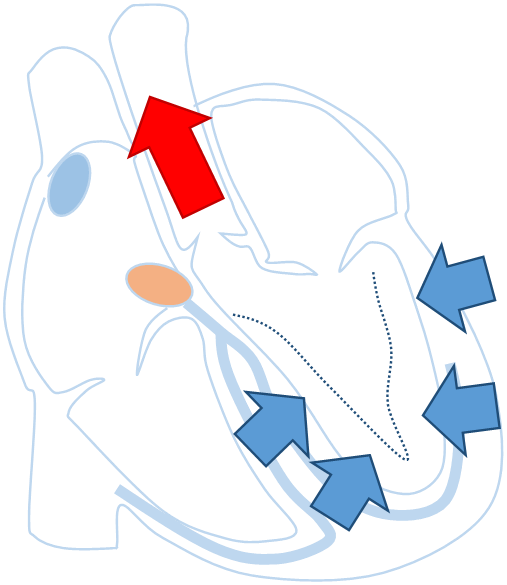
心機能が低下した心臓
全体的に心臓の収縮が低下し、心臓の収縮にズレが生じると、ポンプとしての機能が更に低下する。
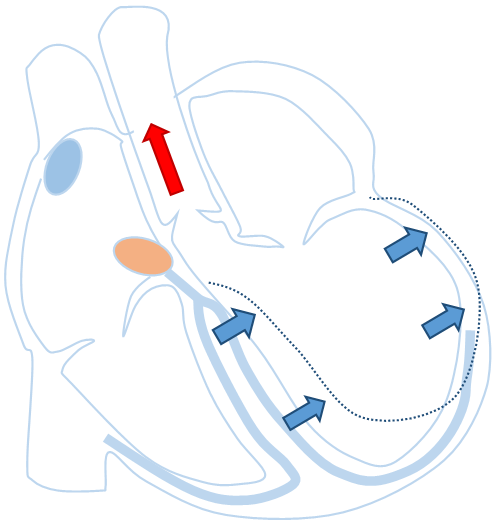
心室の両方からペーシングした心臓
心臓の収縮のズレを補正するため、心室を挟むようにリードを挿入する。同時に心臓を刺激することで、ズレを補正し、弱った心臓のポンプ機能を効率よくする。
心機能が著明に低下している患者さまは、命に関わる不整脈も出やすいため、除細動機能(植込み型除細動器のパンフレット参照)を合わせもったものを使用する場合がほとんどです。本体の大きさもほぼ同じです。
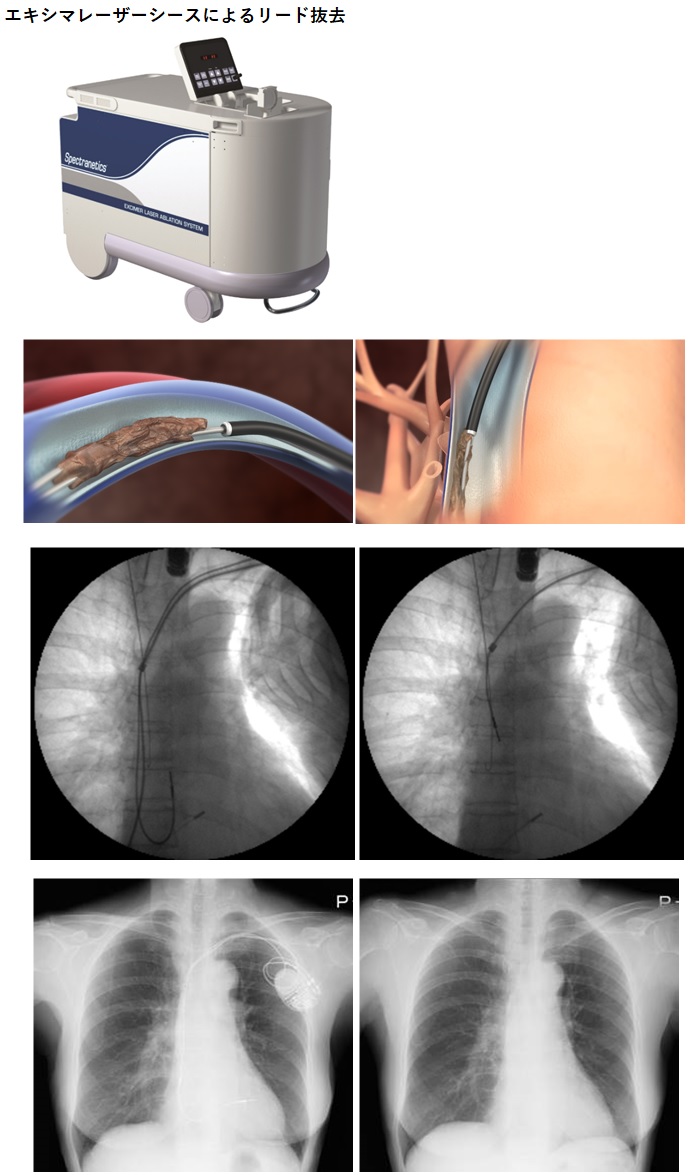
6.経皮的ペースメーカリード抜去術
ペースメーカのリードは植え込まれている年数が長い場合は、静脈や心臓の壁に癒着を起こし牽引しても抜けない状態になります。過度の牽引は血管損傷や穿孔といった致死的な合併症を引き起こす可能性が高く、以前は開胸術や開心術による摘出が行われていました。
経皮的リード抜去術では、スネアやシースなどの機器を使用して抜去する方法があります。2010年エキシマレーザーシース、2011年リードロッキングデバイス、2015年メカニカルシース・スネア、2018年Rotationダイレータシースセットが保険適用となっています。
感染が原因である場合と非感染症例に対するリード抜去術がありますが、適応としては、日本不整脈心電学会がガイドラインを出しております。
感染症例に対しては、すべてのデバイス感染者が適応となります。
非感染症例に対しては、リードあるいはリードの一部分に付着した血栓により引き起こされた臨床歴に有意な血栓塞栓症であり、他に治療手段がない場合、上大静脈狭窄ありいは閉塞が存在し、必要なリード追加が困難な場合、残存するリードが致死的な不整脈の原因となる場合、デバイス本体あるいはリード穿刺部の重篤な疼痛等が適応になり、その他にもガイドラインに適応が示されております。
経皮的リード抜去術の方法として、
①リードを引っ張るだけで抜去する単純けん引法
②リード内にリードロッキングデバイスを挿入しけん引する方法
③血管や心臓との癒着を剥離するために特殊なシースを使う方法があります。
シースは単純な筒状構造になっているメカニカルシース、先端からエキシマレーザを発射できるレーザーシース、Evolution RL Rotationダイレータシースは、先端がドリルのように回転するシースなどがあります。これらは植込み部位からリードを抜去する場合に主に使用され、ペースメーカや除細動器リード周囲の癒着組織を剥離するリード抜去機器です。その他に、補助的な手段として、大腿静脈、内頚静脈など、デバイス植込み部位以外からリード全体または破断したリードの一部を抜去する場合には、リードを把持するスネアを用いたりします。
リード抜去術には、心タンポナーデ、血胸、創部出血、心損傷、弁損傷、塞栓症(血栓、空気、感染性疣贅、リード部分)などの重篤な合併症を起こす可能性があります。これらの合併症が起きた場合には、外科的な緊急手術を要することがあるため、心臓血管外科医のサポート体制が必要である。リード抜去術を実施するためには、実施する医師や施設の要件があります。シースやデバイスに精通し、より多くの経験を積んだ術者が求められます。
下記のハイブリッド手術室にて、心臓外科医の立会いの下にリード抜去施行しております。
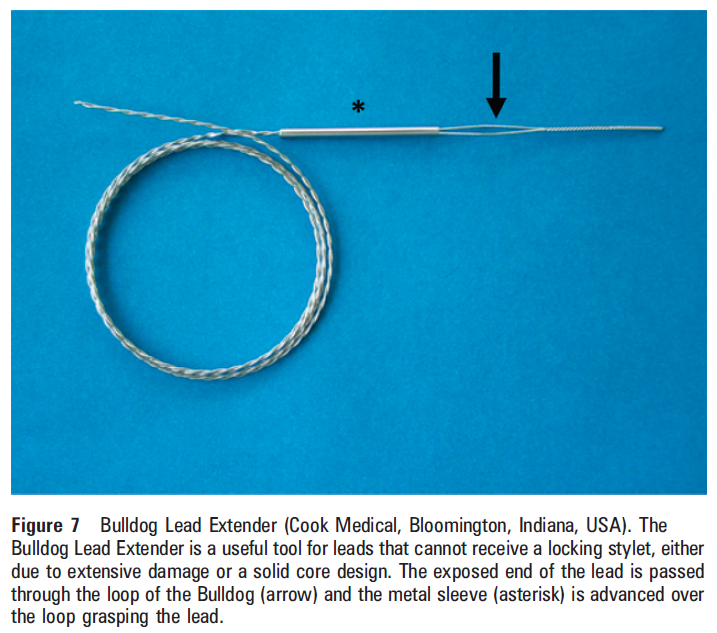
リード抜去に必要なデバイス等
①ロッキングスタイレット

②レーザーシース
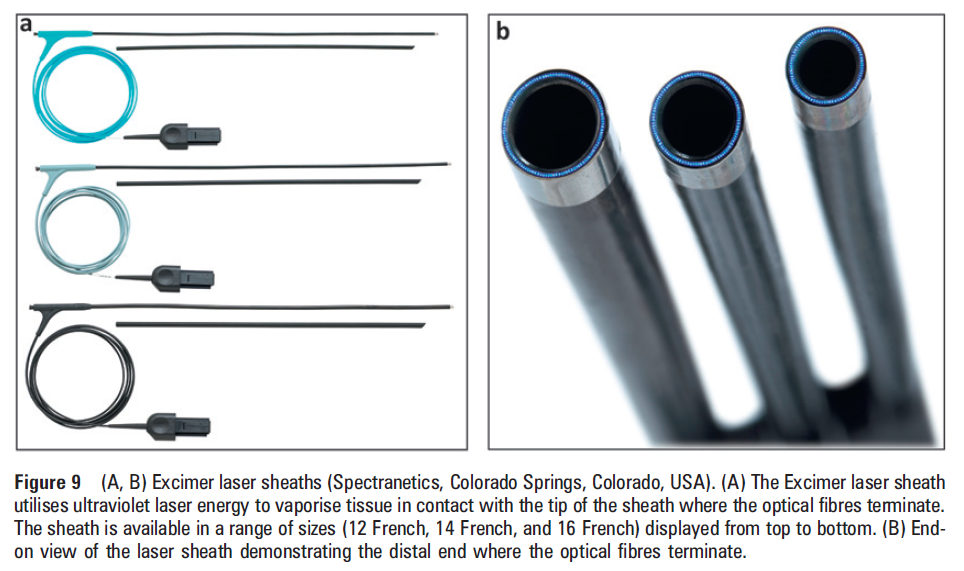
③メカニカルシース

④スネア

⑤Evolution RL Roationダイレータシース

7.経皮的カテーテル大動脈弁置換術・形成術(TAVI・BAV)
「大動脈弁狭窄症」は大動脈弁の開きが悪くなり、血液の流れが妨げられてしまう病気です。65歳以上の大動脈弁狭窄症の罹患率は2〜3%と推定され、65〜100万人の潜在患者さまがいると推測されます。その原因は、加齢に伴う石灰(カルシウム)の堆積によって発症することが多いといわれています。
胸痛、失神、心不全などの症状出現後、急速に進行する病気で、重度大動脈弁狭窄症の5年生存率は、胃癌、肺癌などの疾患と同程度であり、症状が発現した後の生命予後は極めて悪い病気です。その治療の第一選択は外科的人工弁置換術で、全身麻酔管理のもとで、開胸、開心術をおこない、人工弁に置き換えるものです。
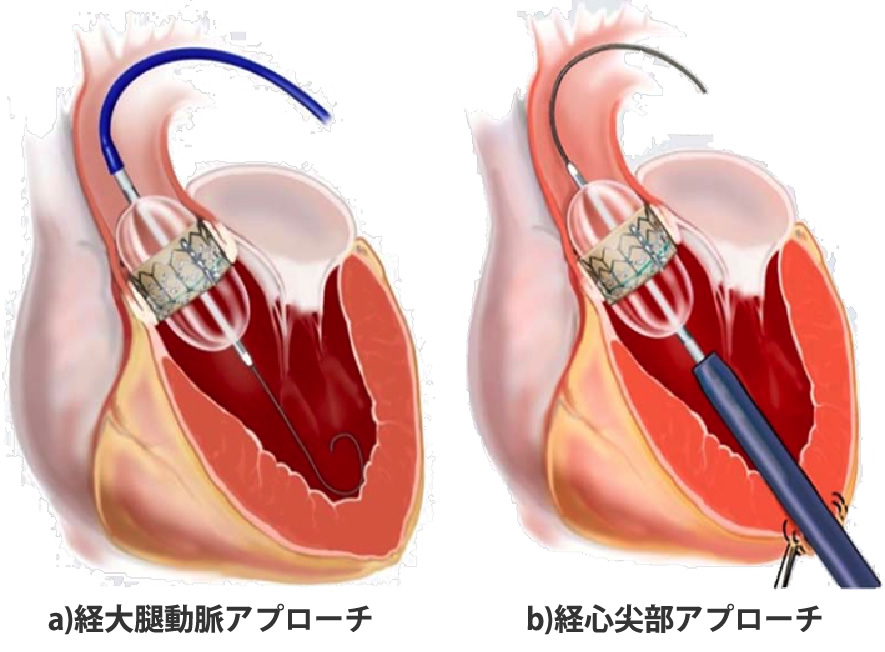
しかし、高齢などで体力が低下している方、他の疾患などのリスクを抱えている方にはハードルが高く、重度の大動脈弁狭窄症の方のうち、少なくとも40-70% の方は、外科的人工弁置換術を受けることができていない状況です。そこで2013年10月から国内でTAVI (TransCatheter Aortic Valve Implantation):経カテーテル的大動脈弁置換術という新しい治療法がはじまりましたが、鹿児島では行うことができず、鹿児島の患者さまを福岡、熊本に紹介し、治療してもらう日々が続きました。
そして2017年6月にようやく鹿児島医療センターで、鹿児島で初めてのTAVIを始めることができました。その特徴は、カテーテルを使用し、開胸することなく、心臓を止めることなく、低侵襲的に心臓に人工弁を留置する方法です。従来の外科手術と比較し、人工心肺を使用しなくて済むことから、身体への負担が少なく、高齢で体力が低下している方や他の疾患リスクを有する方などが対象となりますが、入院期間も短くなることも期待されております。一方、合併症が生じた場合、重篤な状態となる可能性が高く、その治療を選択するにあたっては、循環器内科医、心臓血管外科医、麻酔科医、心エコー医、臨床工学技士、放射線科技師、生理検査技師、各部門の専門看護師が協力して治療にあたる「ハートチーム」を結成し、診療科の垣根を越えて、それぞれの専門分野の知識や経験を駆使し、患者さまに一番良い治療法を選択し、術後管理までそのすべてのプロセスを「ハートチーム」で行っていきます。今後、鹿児島において大動脈弁狭窄症でお困りの多くの患者さまの治療に役立つことを期待しております。
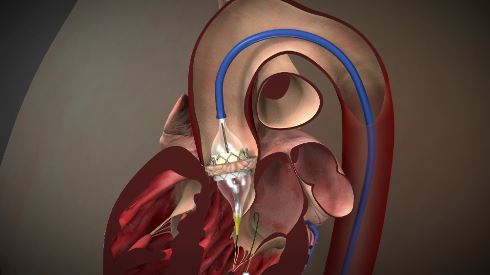
当院でも、ハートチームを立ち上げ、H29.6.29より経皮的カテーテル大動脈弁置換術・形成術(TAVI・BAV)を開始しました。
これからも中央でできる治療を、鹿児島でもいち早く行うことができるよう精進したいと思いますので、よろしくお願いします。
診療の最前線(TAVI関連記事へのリンク)
・2022年4月7日 TAVI指導施設認定 透析患者様へのTAVI可能に・2022年2月2日 経カテーテル大動脈弁置換術(TAVI)400例
8.経皮的僧帽弁接合不全修復術(MitraClip®)
「僧帽弁閉鎖不全症」は僧帽弁という逆流防止の心臓弁の閉鎖が悪くなり、血液が左心室から左心房へと逆流してしまう病気です。こうなると効率的な心臓のポンプ機能が妨げられ、心臓に無理がかかってしまい、心臓の機能が低下し、心不全の状態となってしまいます。
この僧帽弁閉鎖不全症に対する治療は、僧帽弁形成術や人工弁置換術など外科手術が行われております。ただし体力が低下している方・手術による合併症リスクが高い患者さまにはハードルが高く、手術が困難な患者さまには薬物での治療法が行われてきました。しかし薬物治療のみでは根本的な治療にはならず、治療効果に限界があります。
そこで2018年4月から国内で経カテーテル的僧帽弁修復術(マイトラクリップ)という新しい治療法がはじまりましたが、鹿児島では行うことができておりませんでした。
今回2022年2月1日に当院で経カテーテル的僧帽弁修復術の施設認定が得られ、治療が開始できることとなりました。その特徴は、カテーテルを使用し、開胸することなく、心臓を止めることなく、低侵襲に僧帽弁にクリップをかけることで逆流を制御する方法です。従来の外科手術と比較し、人工心肺を使用しなくて済むことから、身体への負担が少なく、高齢で体力が低下したり、他の疾患を有していたりする手術困難な患者さまが対象となります。
循環器内科医、心臓血管外科医、麻酔科医、心エコー医、臨床工学技士、放射線科技師、生理検査技師、各部門の専門看護師が協力して治療にあたる「ハートチーム」によって診療科の垣根を越えて、それぞれの専門分野の知識や経験を駆使し、患者さまに一番良い治療法を選択し、治療ならびに術後管理まで「ハートチーム」で行っていきます。
今後、鹿児島において僧帽弁閉鎖不全症でお困りの多くの患者さまの治療に役立てることを期待しております。
心臓血管外科
心臓血管外科は、下記の認定施設です。
- 日本外科学会外科専門医制度修練指定施設
- 心臓血管外科専門医認定機構基幹施設
- 日本ステントグラフト実施基準管理委員会実施施設(腹部大動脈瘤)
- 経カテーテル的大動脈弁置換術実施施設
- 下肢静脈瘤血管内焼灼術実施・管理委員会実施施設
当院での主な下記の治療について説明します。
1.心臓弁膜症
-
- 僧帽弁閉鎖不全症(Mitral regurgitation: MR)
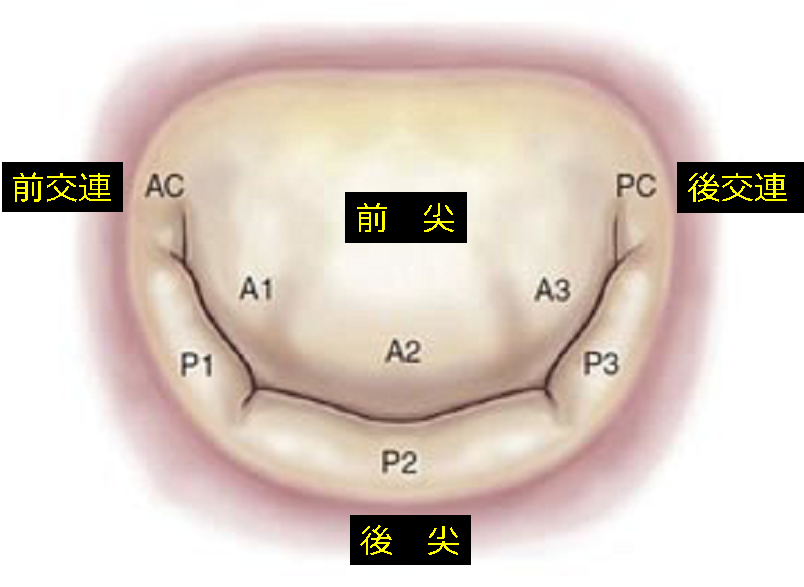
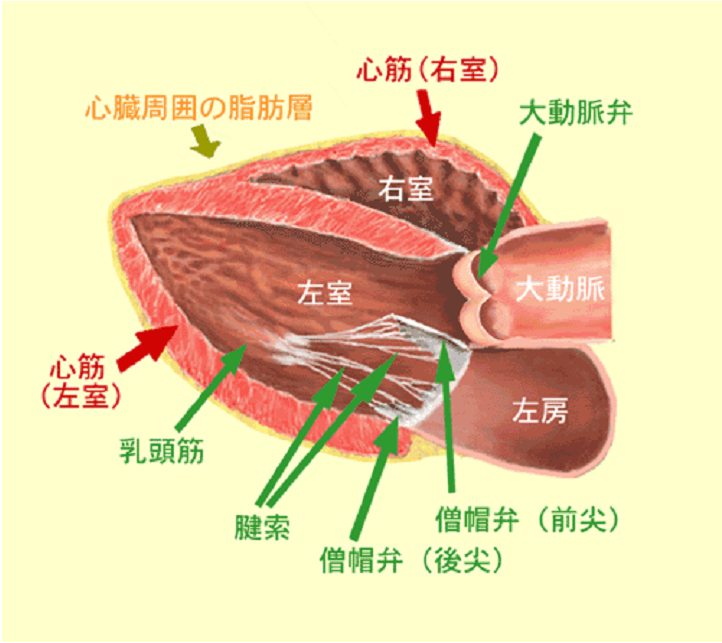
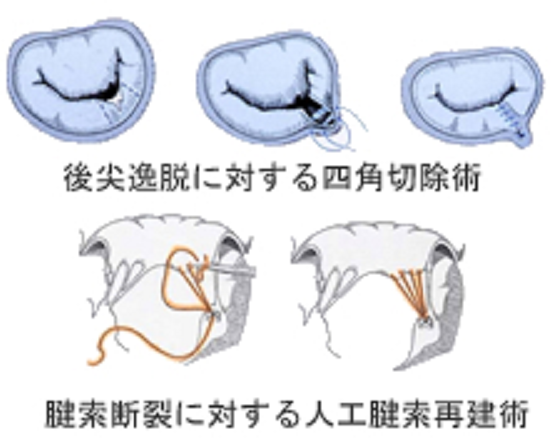
心臓弁膜症の一つである僧帽弁閉鎖不全症(Mitral regurgitation: MR)とは社会の高齢化に伴って増加している心臓弁膜症の一つです。僧帽弁逆流の原因は様々ですが、最も頻度が多いのは退行性病変による弁逸脱であります。僧帽弁逆流の原因疾患で多い順に挙げますと、1)退行性病変による弁逸脱、2)感染性心内膜炎、3)リウマチ性僧帽弁逆流、4)先天性その他、となりますが、心筋梗塞あるいは心筋症によって左心室の拡大、左室収縮の異常によって僧帽弁逆流を生じてくる虚血性僧帽弁逆流も心不全の原因として注目されております。 僧帽弁は大きな前尖と後尖、そしてその両者をつなぐ交連部の弁尖に分けられます。後尖は解剖学的位置からP1 P2 P3の3つに分けられ、それらに相当する前尖部分をA1 A2 A3と呼んでおります。交連部はAC(C1)、PC(C2)と呼んでおり、僧帽弁の構造は弁輪、弁葉、腱索、乳頭筋、左心室壁で構成されており、この構造が病気により破壊されると弁の閉鎖がうまくいかなくなり僧帽弁に逆流を生じてきます(図1)。
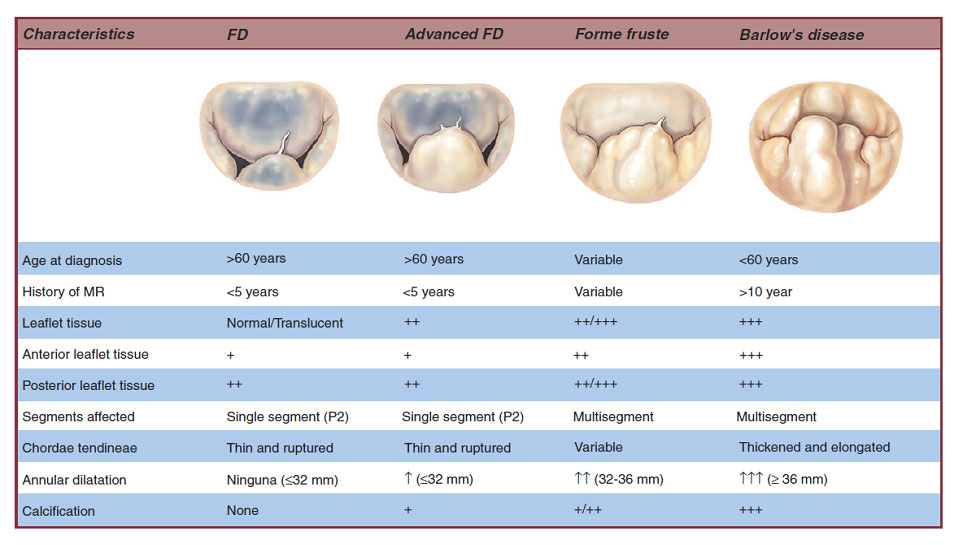
退行性病変、弁逸脱では弁葉と乳頭筋をつなぐ腱索が切れるか、伸びてしまって弁の閉鎖がうまくいかなくなる病気です(図2)。弁逸脱の約半数(50~60%)は後尖の逸脱であり、30~40%は前尖、前後尖両方の逸脱です。逸脱の部位と逆流の程度(重症度)は心エコー図検査によって診断ができます。逆流が軽度(30%未満逆流)あるいは中等度(30%以上50%未満逆流)であれば心臓に負担はかかりませんので普通の生活をされて全く心配ありません。しかしながら、高度(50%以上逆流)の逆流と診断されますと左心室、左心房に逆流する血液量の負担(容量負荷)がかかり、左室の拡大、左室機能の低下、左心房の拡大、不整脈(心房細動)と病気が進行して、息切れなどの症状が出る頃は心臓機能の障害が進んでいて外科治療後の回復に大きな影響を与えます。この病気も日常生活での活動能力の低下を伴う症状と弁膜症の重症度は異なります。症状が出てくるまでに心機能の低下が進行しますので外科治療のタイミングが極めて重要であります。
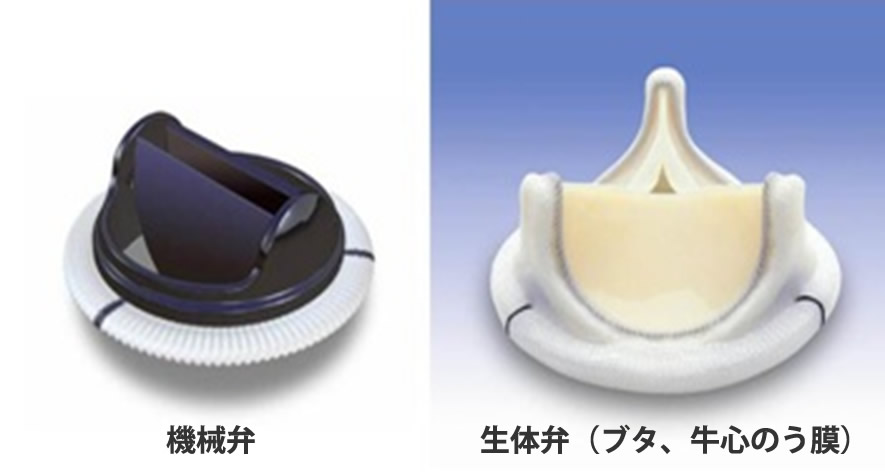
僧帽弁逆流によって息切れや呼吸困難を生じた場合は利尿剤などの投薬で症状は改善しますが、長期的な成績から見て有効な内科的治療は報告されておりません。したがって、高度僧帽弁逆流の場合は外科治療のタイミングとその手術方法が大きな問題となります。 手術方法には僧帽弁の逆流を止めることを目的に、1)僧帽弁形成術、2)僧帽弁置換術に分けられます(図3)。さらに僧帽弁置換術は機械弁あるいは生体弁による人工弁置換術に分けられます。僧帽弁形成術は人工弁置換術と比べて技術的なトレーニングが必要ですが、手術死亡率の低下、左心室機能の回復、手術後合併症の回避と多くの点で優れた術式であると報告されておりますので、僧帽弁逆流に対する手術方法でまず考えられるのは僧帽弁形成術であり、僧帽弁逆流の90%以上で可能であります。当院での僧帽弁形成成功率は98%です。手術後の弁関連合併症の発生頻度が形成術により大きく改善します。したがって現在の治療ガイドラインにも掲げてありますが、いかなる僧帽弁逆流も技術的に形成術が可能であれば形成術が推奨されるとなっております。形成術の困難な僧帽弁疾患が10%以下の患者さまでありますので、こうした場合は機械弁あるいは生体弁を用いた人工弁置換術となります。
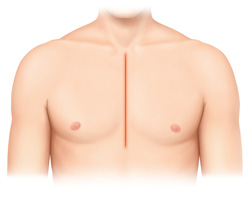
通常の手術は胸骨正中切開にて行われますが、当院では2014年4月から導入してきた右小肋間開胸による僧帽弁形成術は2017年9月の3年6か月までに、27例に施行してきました。この分野に関しても鹿児島県内ではほとんど他施設では行われておりません。従来の25~30 cm近い胸の真ん中を切開する胸骨正中切開に比べて皮膚切開8 cmという右小肋間開胸切開で低侵襲手術することで、胸骨感染のリスクもなく、美容的にも傷が目立ちません。さらに早期回復、早期退院、早期社会復帰を得ることができております。しかし、手技の難度は高くなるので適応は慎重に判断し、手術の質を落とさないように細心の注意を払っています。今後も適応拡大をはかり、その症例数を伸ばしていく所存であります(図4)。
(図1)僧帽弁の解剖
(図2)僧帽弁逸脱
(図3)a)僧帽弁形成術
b)僧帽弁置換術(人工弁)
(図4)a)低侵襲僧帽弁手術(右小肋間開胸による)
通常の胸骨正中切開(25~30 cm切開)
右小肋間開胸(8 cm切開)
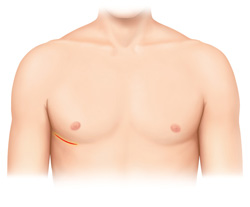
b)右小肋間開胸創部写真(8 cm切開)
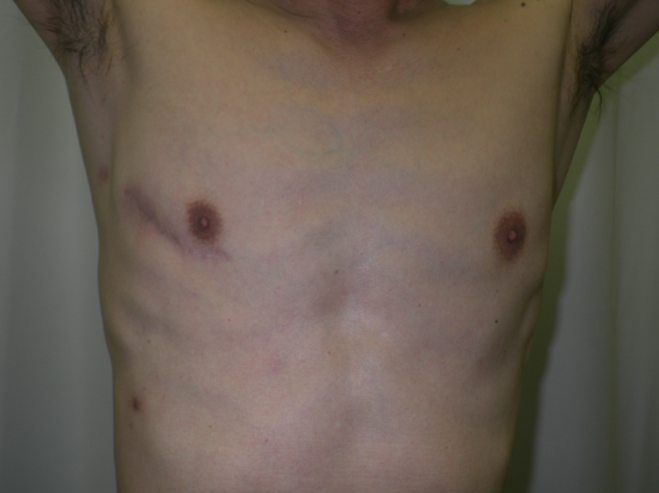
c)術野写真(写真左側が頭側)
-
- 大動脈弁狭窄症(Aortic stenosis: AS)
大動脈弁疾患に対する標準的術式は、人工弁による大動脈弁置換術である。人工弁は耐久性に優れるが、抗凝固療法が必須である機械弁と、耐久性に劣る(10~15年での構造劣化)ものの、抗凝固療法は短期間で済む生体弁に分類することができる。どちらも大動脈弁輪に縫合、固定するためのステント構造を有しており、これが大動脈弁輪の可動性を阻害するなどし、術後の大動脈弁口面積の減少や大動脈弁位圧格差の増大、さらには患者さま-人工弁ミスマッチ (patient prosthesis mismatch:PPM)につながる症例も経験する。また、体格が小さく狭小弁輪の症例では最小の人工弁でも弁置換が困難な症例もあり、侵襲的操作である弁輪拡大やステントレス弁を使用した大動脈基部置換術を行わざるを得ないこともある。近年では、僧帽弁治療に始まった抗凝固療法が不要で、術後のQOL(quality of life)の改善が見込まれる、自己弁を温存する形成術が盛んに行われる傾向にあり、大動脈弁疾患に対しても、弁形成,弁再建術が行われる機会が増加している。しかしながら、大動脈弁形成、再建術施行が可能な条件として、大動脈弁尖の性状が保たれていることが重要で、近年の高齢化社会に伴い、増加している弁尖に石灰化を認める大動脈弁狭窄症(Aortic stenosis: AS)の症例では開胸による人工弁置換が必要で標準術式であります(図5a)。
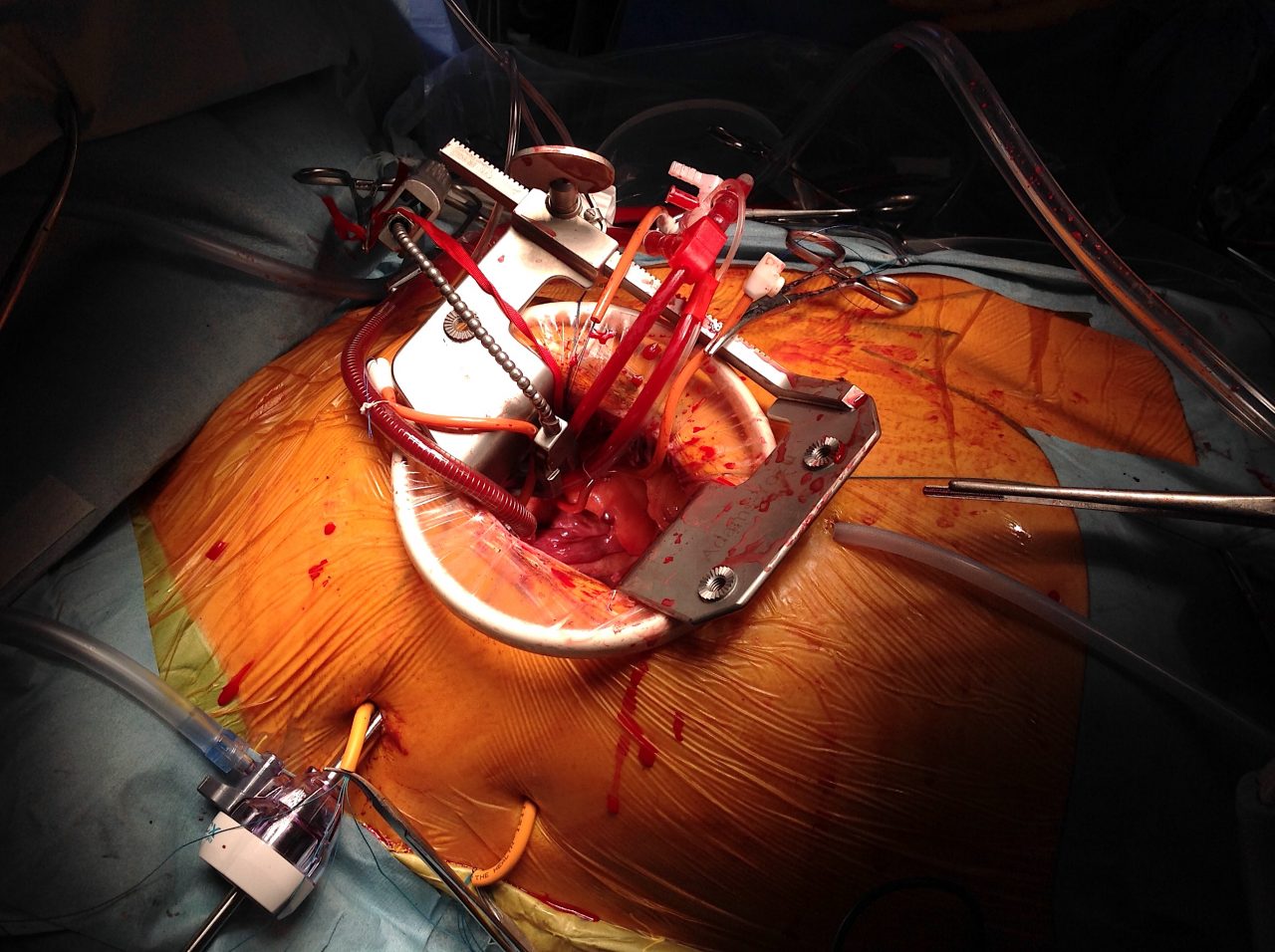
2017年3月から当院手術室にハイブリッド手術室(X線透視を兼ね備えたクリーン室)を増設し、その稼働を開始しました。このハイブリッド手術室増設稼働の最大の目的は経カテーテル的大動脈弁置換術(Transcatheter aortic valve implantation: TAVI)の実施でした。そのTAVI関連学会事務局の視察を2017年4月14日に受け、5月10日にTAVI実施施設に鹿児島県内初、認可されました。これまで80歳以上の高齢者で開胸手術による大動脈弁置換術では非常に危険性を伴う方には大変メリットの大きい方法です。そして、2017年6月29日には鹿児島県内初のTAVIが当院で行われたことは今後の鹿児島県内のハイリスク高齢者大動脈弁狭窄症の治療貢献には大変意義があります。さらにその後も順調にTAVI症例数を伸ばし、現在まで良好な治療成績を収めております。TAVI導入には他県に比べてやや遅れましたが、この間に小柄な体格の日本人に合った小口径のシステムが登場し、カテーテル弁にも漏れ防止スカートが追加された改良型のSAPIEN 3というデバイスを初めから使用できたことは幸運であったと思います。今後もますます、症例数を伸ばすことが期待できそうです(図2)。また、2017年5月26日には日本だけならず、世界でもその第一人者である東邦大学医療センター大橋病院心臓血管外科 尾崎重之教授を当院に招聘し、重症大動脈弁狭窄症の方に対して鹿児島県内初となる自己心膜を用いた大動脈弁再建術(AV Neo-cuspidization)を行い、成功いたしました。これは今まで人工弁置換を受けていた患者さまにとっては人工弁置換を要しない、術後抗凝固治療が不要の画期的な手術手技であり、大変メリットの大きい手術であります。その後は当科スタッフのみによる大動脈弁再建術を8月29日、9月5日に1例ずつ行い、非常に良好な結果を得ております。今後もその適応患者さまを増やして、症例数を重ねていき、鹿児島県内の患者さまにその恩恵を受けていただけるようにしていく所存であります(図5b)。
(図5)a)外科的大動脈弁置換術(SAVR)
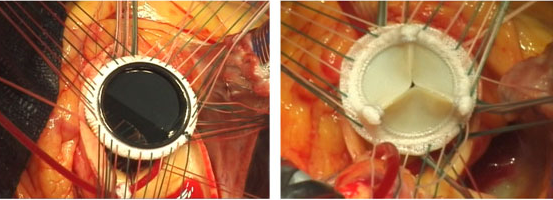
b) 経カテーテル的大動脈弁置換術(TAVI or TAVR)
-
- 大動脈弁閉鎖不全症(Aortic regurgitation: AR)
大動脈弁閉鎖不全症(Aortic regurgitation: AR)は近年、人工弁置換術に変わって人工弁使用を回避する大動脈弁形成術が進歩普及してきている。大動脈弁形成術の適応は、大動脈弁尖の性状が保たれている大動脈弁閉鎖不全症ということになる。大動脈弁閉鎖不全症はその弁尖運動の所見により3つに分類することができる。すなわち、弁尖の動きには異常は認められないType I、弁尖の逸脱(prolapse)を認めるType II、弁尖の運動制限を認めるType IIIである。Type Iでは、弁尖は大動脈弁輪の動脈側に位置しており、弁尖の運動自体には異常は認められないものである。大動脈弁逆流が発生する原因としては、弁尖の接合部(coaptation zone)の 短縮や弁尖の穿孔(perforation)が挙げられる。接合面(coaptation zone)の短縮は,大動脈弁輪拡張症(annuloaortic ectasia :AAE)などに伴う弁輪部の拡大、バルサルバ洞の拡大や急性大動脈解離や上行大動脈瘤に伴うST junctionの拡大などが原因となる。弁尖の穿孔は、主に感染性心内膜炎による弁尖の破壊が原因となることが多い。Type IIでは弁尖が拡張期に心室側に逸脱することで発生する。弁尖の接合が得られず、非逸脱弁尖方向に変位した逆流ジェットを認める。原因としては、交連部の損傷や弁尖の亀裂、弁尖自由縁の延長などが挙げられる。Type IIIは大動脈弁尖の1 枚,2枚あるいは全ての運動が制限されることで、弁尖同士の接合が障害されるものである。原因としては、石灰化によるものやリウマチ性のものが挙げられる。大動脈弁狭窄症を伴うことも多い。
-
- AAEに対する自己大動脈弁温存基部置換術
AAEに対する手術として従来の人工弁を使用した大動脈基部置換術(Bentall operation)に代わる術式として、自己弁尖を温存して大動脈基部を置換する術式が行われている。この術式は、弁輪上から人工血管置換を行い、バルサルバ洞や弁輪部の運動制限が少ないRemodeling法と弁下部から弁輪部を覆うように人工血管置換術を行い、大動脈弁輪拡張に対して縫縮効果が望まれるReimplantation法が挙げられる。当院でも大動脈弁輪拡張症(Annuloaortic ectasia:AAE)や aortic root aneurysmに合併した大動脈弁閉鎖不全症(Aortic regurgitation: AR)に対して従来、人工弁と人工血管のcomposite graftを用いた大動脈基部置換(Bentall手術)を行っており、その手術成績も良好でした。近年、自己大動脈弁温存手術(valve-sparing operation),特にReimplantation (David手術)が注目されており、当科でも2013年3月から現在まで適応のある症例に対して積極的にReimplantation (David Ⅴ)手術に挑戦しています。患者さまにとっては人工弁フリー、ワーファリンフリーの生活が術後待っており、患者さまのQOL向上、さらに人工弁関連合併症の回避、予後の改善に貢献する手術であると認識している。鹿児島県内では特に当センターは僧帽弁閉鎖不全症に対する僧帽弁形成術と同じくこの手術に力を注いでいる。2013年3月から2017年9月までに当科でAAEや aortic root aneurysmに合併したARに対してReimplantation (David Ⅴ)手術を16例に施行し、手術死亡なく、大動脈弁逆流制御良好と良好な成績をあげています(図6)
(図6)a)自己大動脈弁温存基部置換術
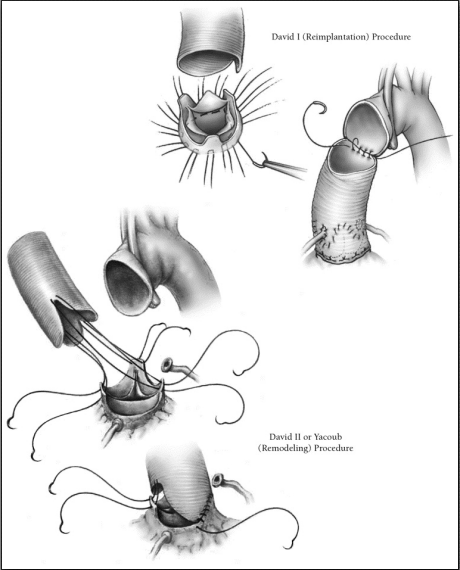
b) 人工弁を使用した大動脈基部置換術(Bentall手術)
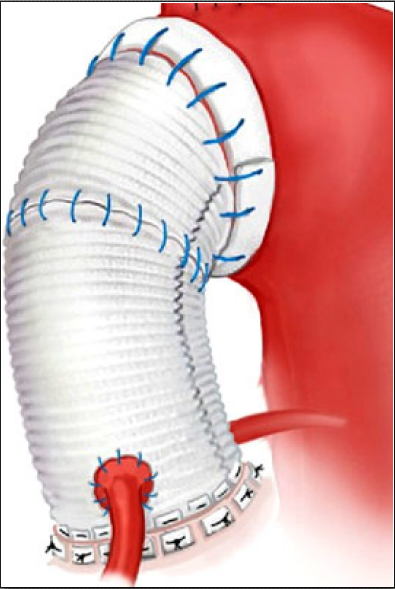
-
- 急性大動脈解離,上行大動脈瘤による大動脈弁閉鎖不全に対する手術
大動脈解離や動脈瘤に伴う上行大動脈、ST junctionの拡大は、大動脈弁尖の接合不全を引き起こし、大動脈弁逆流の原因となる。このような症例では、大動脈弁尖自体に異常を認めなければ、大動脈弁交連部をつり上げ固定、あるいはST junction以上の人工血管置換にて大動脈弁逆流の改善を認める。
-
- 弁尖穿孔(感染性心内膜炎)に対する形成術
感染性心内膜炎による大動脈弁尖の破壊によっても、大動脈弁逆流は発生する。弁尖の破壊が大動脈弁腹に限局しており、弁尖自由縁の性状が保たれていて、弁輪部への感染波及が認められなければ、弁尖穿孔部のパッチ閉鎖にて対応することも可能である。
-
- 弁尖逸脱に対する形成術
大動脈弁尖の逸脱による大動脈弁逆流に対する弁形成術は、いくつかのテクニックが報告されている。弁腹をひだ状に縫合し,弁尖全体を大動脈側に引き上げるcentral plication、弁尖の自由縁に連続で針糸をかけて、それを両側の大動脈交連部方向に牽引することで、弁尖自由縁を引き上げるcusp resuspensionまたは free margin reinforcement、また、僧帽弁尖の逸脱に対する形成術と同様のテクニックを用いて、弁尖逸脱部を切除縫合するtriangular resection などである(図7)。
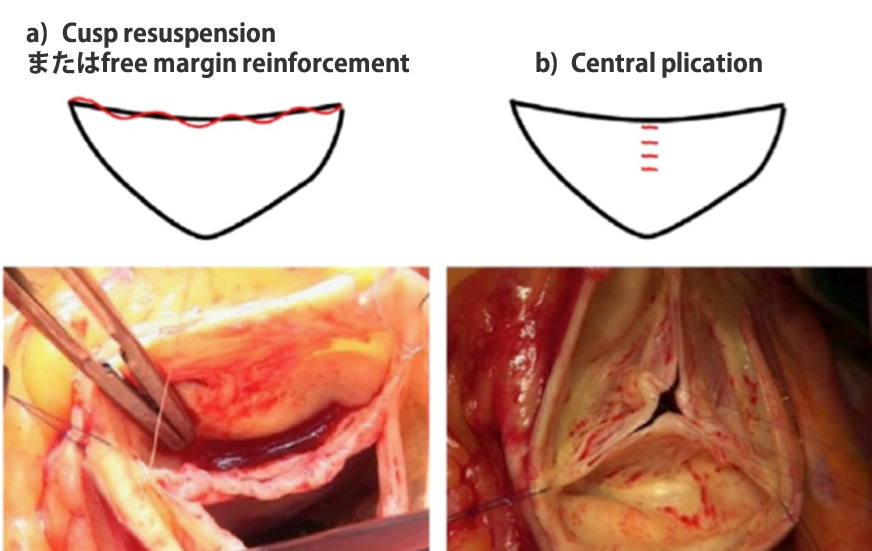
-
- 弁尖の運動制限を認める大動脈弁逆流に対する形成術
リウマチ性変化や石灰化を伴う大動脈弁逆流に対しても、人工物を使用しない弁形成術が行われている。リウマチ性変化に伴う交連部の癒合を認める症例では、弁尖の変化が少なければ、交連部の切開にて弁尖の可動性改善が期待される。以前には,弁尖の肥厚に対して、弁腹をスライス状に切除するshavingや石灰化弁尖に対する石灰化除去(decalcification)も行われていたが、術後の再発が高率に認められることから、今日では積極的には行われていない。運動制限のある弁尖の性状によっては、弁尖の延長が行われることもある。延長に使用する素材としては、グルタールアルデハイド処理された自己心膜が一般的である 。
-
- 二尖弁に対する形成術
大動脈二尖弁は、1~2%に発生する先天的に弁尖が2枚である心疾患であるが、比較的若年から大動脈弁逆流あるいは狭窄症を呈する。二尖弁では交連部間距離に対して弁尖自由縁長が短いために、弁尖自由縁が正常に比較して下方(左室方向)に下がり、弁尖が左室方向に逸脱することで開放される特徴がある。そのために大動脈弁閉鎖時にも弁尖の逸脱があると逆流が生じることとなる。逸脱のコントロールには前述したように、central plication や cusp resuspensionなどのテクニックが使用される。また、大動脈基部置換術と同時に交連部を上方に引き上げて固定する術式も行われている。縫線(raphe)のある二尖弁の場合には癒合した弁尖を切開し、三尖弁化する術式も行われているが、rapheの交連部は正常な交連部に比較して低く位置するために、逆流のコントロールや遠隔期の再発などに問題があることも懸念される。
-
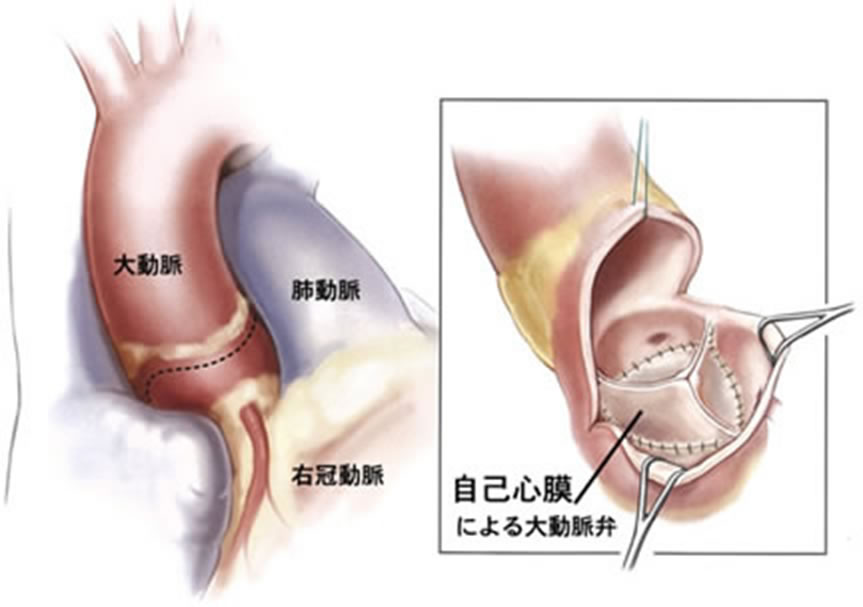
- 自己心膜を使用した大動脈弁再建術(AV Neo-cuspidization)
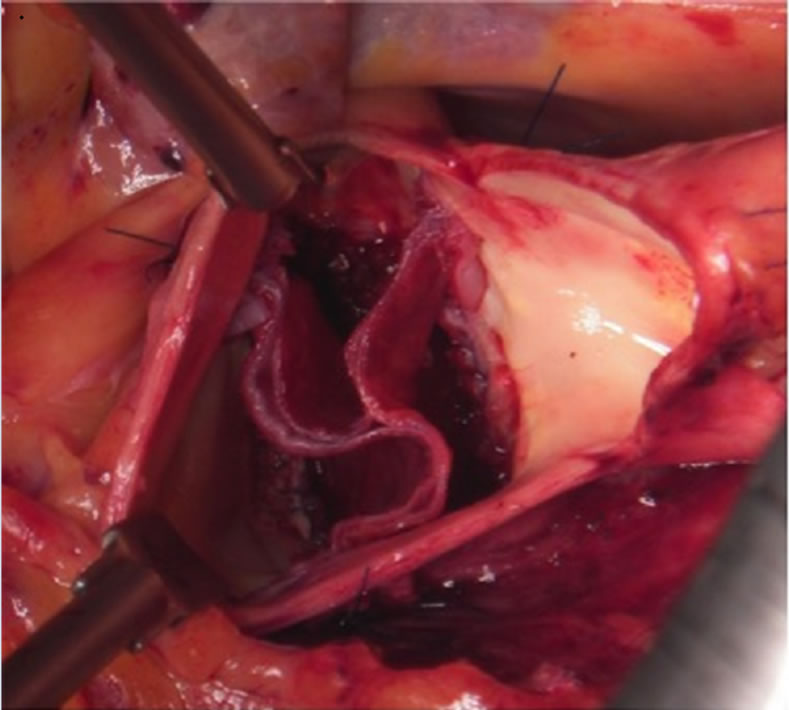
大動脈弁疾患に対する治療として、2007年より自己心膜を使用した大動脈弁再建術が施行されている。この術式は大動脈弁尖を完全に切除し、グルタールアルデハイド処理した自己心膜から作成した弁尖を大動脈弁輪に直接、縫着する術式である。この術式は大動脈弁閉鎖不全症だけでなく、大動脈弁狭窄症などの大動脈弁疾患に対して幅広く適応することが可能で、二尖弁、単尖弁、四尖弁にも応用することができる。また、弁尖の性状が不良なAAE、感染性心内膜炎、大動脈弁置換術後の症例に対しても施行可能である。人工弁を使用せず、自己心膜を使用しているために術後の抗凝固療法は不要で、弁輪部に直接弁尖を縫合することで、より大きな弁口面積が確保できる特徴がある。そのために、狭小弁輪症例に対しても弁輪拡大などの侵襲的な処置を行うことなく手術が施行できる利点がある。当院でも2017年5月26日には日本だけならず、世界でもその生みの親、第一人者である東邦大学医療センター大橋病院心臓血管外科 尾崎重之教授を当院に招聘し、重症大動脈弁狭窄症の方に対して鹿児島県内初となる自己心膜を用いた大動脈弁再建術(AV Neo-cuspidization)を行い、成功いたしました。これは今まで人工弁置換を受けていた患者さまにとっては人工弁置換を要しない、術後抗凝固治療が不要の画期的な手術手技であり、大変メリットの大きい手術であります。その後は当科スタッフのみによる大動脈弁再建術を8月29日、9月5日に1例ずつ行い、非常に良好な結果を得ております。今後もその適応患者さまを増やして、症例数を重ねていき、鹿児島県内の患者さまにその恩恵を受けていただけるようにしていく所存であります(図8)。
(図8)a)自己心膜を使用した大動脈弁再建術 (AV Neo-cuspidization)
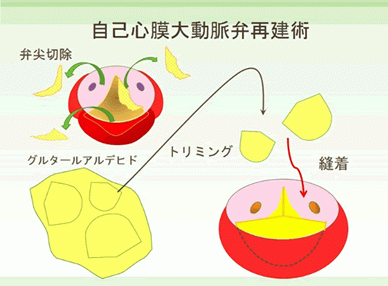
b)自己心膜大動脈弁再建後の写真
2.冠動脈バイパス術
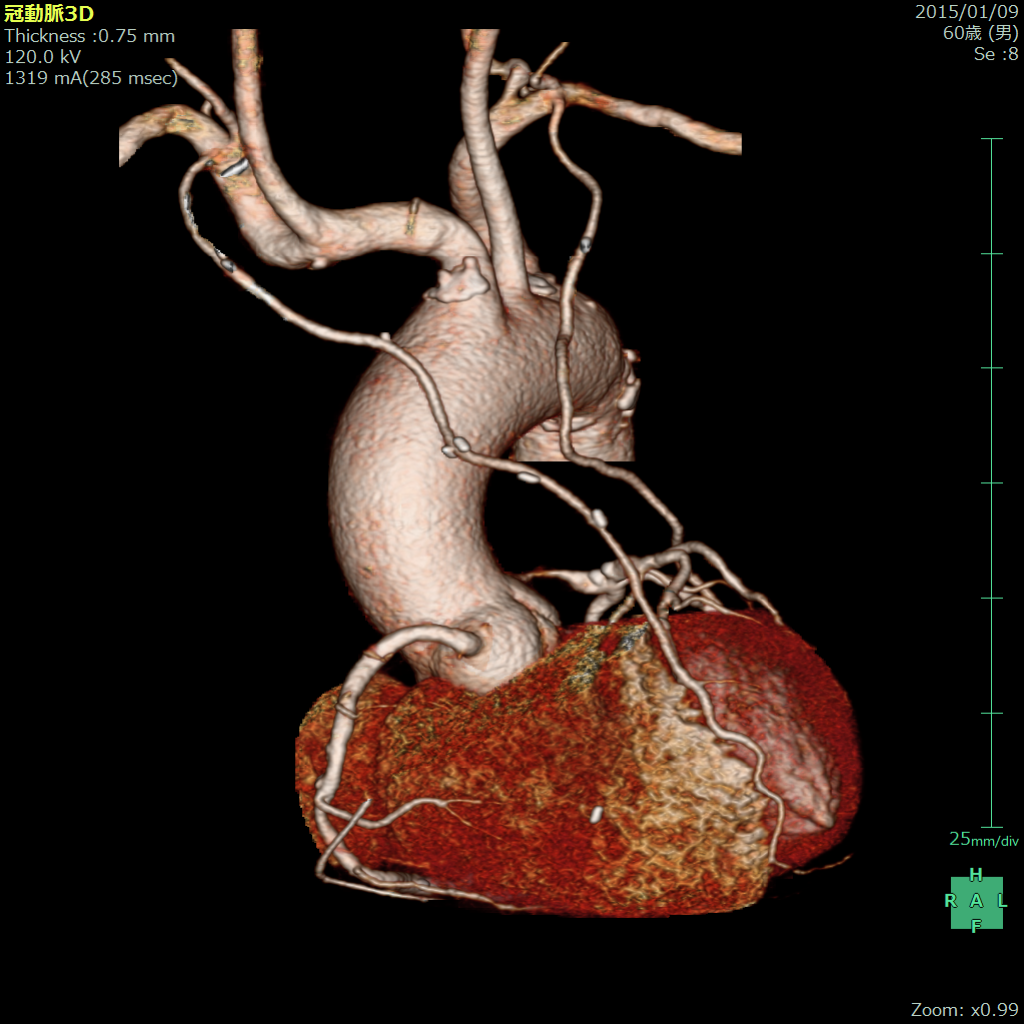
狭心症、心筋梗塞による冠動脈バイパス術は経カテーテル治療(Percutaneous coronary intervention: PCI)の飛躍的な進歩、発達により減少しています。しかし、減少した中でさらにその治療対象患者さまは多くの合併症を有したますますハイリスク患者となってきております。欧米に比較して心拍動下冠動脈バイパス術(Off pump coronary arterial bypass grafting: OPCAB)が盛んに施行されてきた本邦ではありますが、ここに来て改めて人工心肺使用下の冠動脈バイパス術(Conventional coronary arterial bypass grafting: CCAB)の長期成績が見直されてきております。今後はそのようなハイリスク患者でも治療成績を落とすことなく、質の向上を目指し、静脈グラフトより長期開存性が得られる動脈グラフトを多用した術式を選択して、その有用性と意義を高めていくことになると思います(図9)。
(図9)両側内胸動脈グラフトを用いた心拍動下冠動脈バイパス術後3D-CT
3.胸部大動脈瘤・腹部大動脈瘤手術
胸部大動脈瘤、腹部大動脈瘤の領域は依然、開胸や開腹を必要とする人工血管置換術が標準術式であります。しかし、現在では瘤形態やその位置によっては開胸や開腹を要しない胸部大動脈瘤に対するステントグラフト挿入術(Thoracic endovascular aortic repair: TEVAR)、腹部大動脈瘤に対するステントグラフト挿入術(Endovascular aortic repair: EVAR)が可能であります。すでに当院でも導入しており、現在はその適応を拡大しています。胸部大動脈瘤に対するステントグラフト挿入術の登場により従来の開胸下の人工血管置換術症例は減少していますが、呼吸機能障害などの多くのリスクを持つ患者さまや高齢者に対しては大変有用な治療手段となっています。血管内治療の登場で胸部大動脈瘤、腹部大動脈瘤症例は全国的にみても増加の一途をたどっていますが、この領域に関してもハイブリッド手術室の稼働により手技の安全性も高まりさらに増加していくものと思われます(図10)。
(図10)a)ステントグラフト内挿術
b) オープンステントグラフト内挿と併用した人工血管置換術
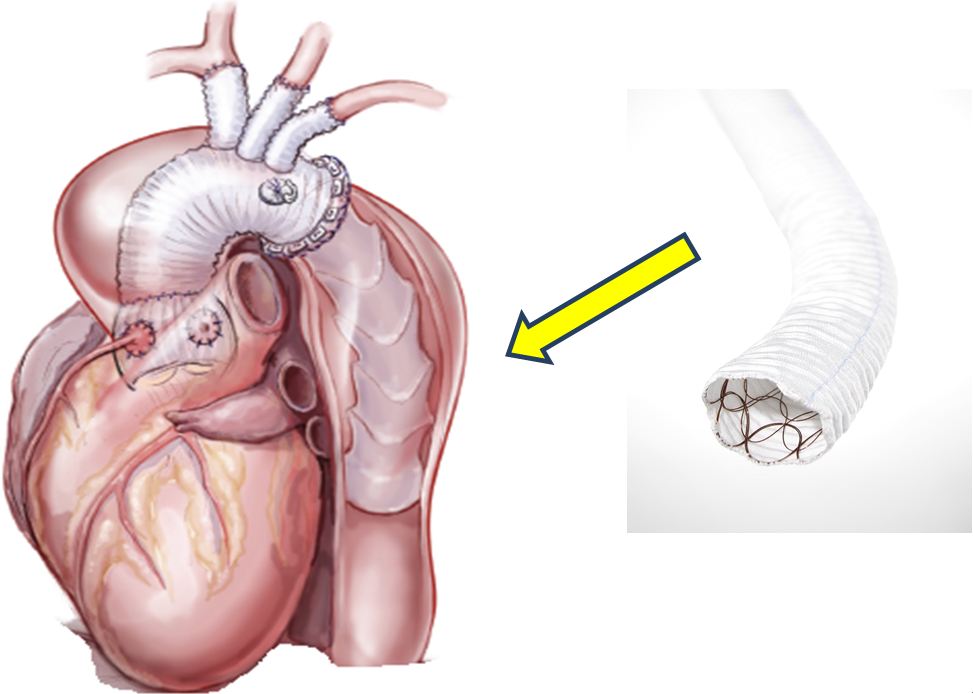
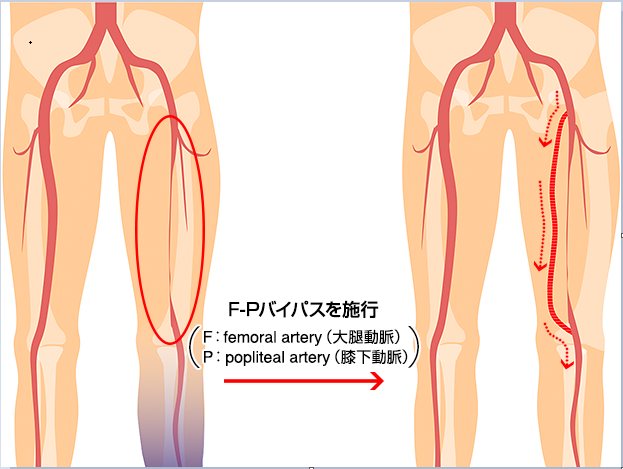
4.末梢血管手術
閉塞性動脈硬化症(ASO)は、動脈硬化が基盤となって粥腫形成、血栓ができ血管が詰まるという発症経過を示します。特にASOを有する患者さまにおける心筋虚血有病率は55%にも及び、重症のASO患者さまの生命予後は不良であるといわれています。ASOに糖尿病が合併すると心血管死がさらに増加することも分かってきました。これまでシロスタゾールやスタチンなどの内服に加え、腸骨動脈領域を中心に末梢動脈インターペンション(PTA)が行われております。さらには最新のステント進歩により大腿動脈以下のPTA治療も増えてきております。PTAとは冠動脈と同じように、骨盤部や下肢の末梢血管の動脈硬化による狭窄・閉塞部を細いカテーテルに装着したバルーン(風船)やステント(金属の筒状のもの)を使用して、病変部を拡張させることにより血流を改善させる治療です。そのため、外科的に人工血管や自家静脈を使用した下肢バイパス術の症例数は減少の一途ですが、PTA不可能な症例にはまだまだ必要で有効な手段であります(図11)。
(図11)下肢バイパス術
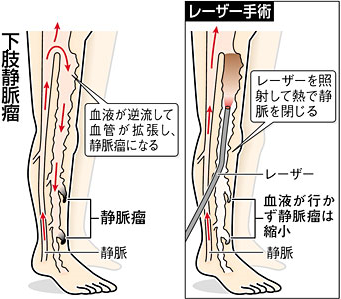
5.下肢静脈瘤手術
下肢静脈瘤は以前の下肢静脈抜去術に変わり、小さな傷穴一つで済む血管内レーザー焼灼術が主流となってきています。当院もすでに下肢静脈瘤血管内焼灼術実施・管理委員会が認定する実施施設となっており、積極的に下肢静脈瘤レーザー治療術を行っております(図12)。
(図12)下肢静脈瘤レーザー治療
【診療実績】
2005年から2019年までのNCD登録データに基づく手術症例数を示します。
開心術246例(心臓弁膜症98例、冠動脈バイパス術 65例(内、心拍動下冠動脈バイパス術 20例)、胸部大動脈瘤 64例、その他19例)、腹部大動脈瘤 110例、末梢血管 50例、下肢静脈瘤 63例で総数 469例です。
2021心外手術総数
2021年手術総件数 346件
| 虚血性心疾患 | 63 |
| (人工心肺なし) | (46) |
| (複合手術) | (19) |
| 弁膜症 | 93 |
| (複合手術) | (37) |
| 胸部大動脈瘤 | 77 |
| (複合手術) | (10) |
| 腹部大動脈瘤 | 57 |
| (複合手術) | (2) |
| 先天性心疾患 | 3 |
| 末梢血管、静脈疾患 | 27 |
| その他 | 26 |
※その他
膿胸腔有茎大綱充填術、ペースメーカー植込術、収縮性心膜炎、心室中隔穿孔、左房内腫瘍、肺梗塞など








